آب ژاول
هیپوکلریت سدیم با نام تجاری آب ژاول که در فارسی به آن مایع سفیدکننده و وایتکس (نام یکی از سازندهها) نیز گفته میشود و بوی تند و شدیدی دارد، محلولی است که برای گندزدایی، سفیدکردن و بو زدایی سطوح مخصوصا هنگام خانه تکانی به کار میرود.
| Sodium hypochlorite | |||
|---|---|---|---|
| |||
| |||
دیگر نامها Sodium chlorate(I) | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۸۱-۵۲-۹ | ||
| پابکم | ۲۳۶۶۵۷۶۰ | ||
| کماسپایدر | ۲۲۷۵۶ | ||
| UNII | DY38VHM5OD | ||
| شمارهٔ ئیسی | 231-668-3 | ||
| شمارهٔ یواِن | 1791 | ||
| KEGG | D01711 | ||
| شمارهٔ آرتیئیسیاس | NH3486300 | ||
| کد اِیتیسی | D08 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
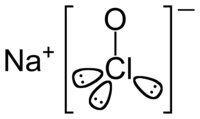
| فرمول مولکولی | NaOCl | ||
| جرم مولی | 74.442 g/mol | ||
| شکل ظاهری | greenish-yellow solid | ||
| بوی | disagreeable and sweetish | ||
| چگالی | 1.11 g/cm3 | ||
| دمای ذوب | ۱۸ درجه سلسیوس (۶۴ درجه فارنهایت؛ ۲۹۱ کلوین) | ||
| دمای جوش | ۱۰۱ درجه سلسیوس (۲۱۴ درجه فارنهایت؛ ۳۷۴ کلوین) | ||
| انحلالپذیری در آب | 29.3 g/100mL (0 °C) | ||
| اسیدی (pKa) | >7 | ||
| خطرات | |||
| MSDS | ICSC 1119 (solution,>10% active chlorine) ICSC 0482 (solution, <10% active chlorine) | ||
| شاخص ئییو | ۰۱۷-۰۱۱-۰۰-۱ | ||
| طبقهبندی ئییو | Corrosive (C) Dangerous for the environment (N) | ||
| کدهای ایمنی | R31, R۳۴, R50 | ||
| شمارههای نگهداری | (S1/2), S۲۸, S45, S۵۰, S61 | ||
| لوزی آتش | |||
| ترکیبات مرتبط | |||
| دیگر آنیونها | سدیم کلرید سدیم کلریت سدیم کلرات سدیم پرکلرات | ||
| دیگر کاتیونها | لیتیم هیپوکلریت کلسیم هیپوکلریت | ||
| ترکیبات مرتبط | هیپوکلرو اسید | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||

کاربرد
ویرایشآب ژاول را برای گندزدایی و بوزدایی به کار میبرند. از این ماده در صنعت به عنوان رنگزدا و سفیدکننده پارچه و خمیر کاغذ استفاده میشود. در خانهها برای ضدعفونی کردن و سفید کردن رختها به هنگام رختشویی از آب ژاول استفاده میکنند. این محلول با نامهای گوناگون در بازار به فروش میرسد.[۱]
ویژگیهای شیمیایی
ویرایشآب ژاول یا وایتکس که مایعی سفید کننده بهشمار میرود، محلولی است حاوی درصدی از سدیم هیپوکلریت (NaOCl) محلول در آب. این نسبت بسته به مصارف مختلف، متفاوت است.[۲][۳]
آب ژاول مادهای سمی است. رنگ آن نزدیک به زرد و طعم و بوی آن تند است. خاصیت ضدعفونیکننده آب ژاول به دلیل تولید کلر آزاد میباشد. اگر با آب جوش ترکیب شود باعث آزاد شدن گاز کلر میشود. چنانچه به اشتباه نوشیده شود باید فوراً شیر نوشید.[۴]
نحوه عملکرد
ویرایشسفیدکنندگی
ویرایشرنگهای مواد آلی طبیعی معمولاً از رنگدانههای آلی مانند بتاکاروتن به وجود میآیند. سفیدکنندههای شیمیایی به یکی از دو روش عمل میکنند:
1- یک سفیدکننده اکسیدکننده با شکستن پیوندهای شیمیایی که کروموفور را تشکیل میدهند، عمل میکند. این کار مولکول را به یک ماده دیگر تبدیل میکند که یا کروموفور ندارد یا کروموفوری دارد که نور مرئی را جذب نمیکند. این مکانیزم سفیدکنندههای مبتنی بر کلر و همچنین آنیونهای اکسیژن است که از طریق حمله هستهدوست اولیه واکنش نشان میدهند.[۵]
2- یک سفیدکننده کاهنده با تبدیل پیوندهای دوگانه به پیوندهای تکی در کروموفور عمل میکند. این کار توانایی کروموفور برای جذب نور مرئی را از بین میبرد. این مکانیزم سفیدکنندههای مبتنی بر دیاکسید گوگرد است.[۶]
نور خورشید به عنوان یک سفیدکننده عمل میکند از طریق فرآیندی که به نتایج مشابه منجر میشود: فوتونهای پرانرژی نور که اغلب در محدوده بنفش یا فرابنفش، میتوانند پیوندهای کروموفور را مختل کنند و ماده نهایی را بیرنگ کنند. قرار گرفتن طولانیمدت در معرض نور خورشید معمولاً به تغییر رنگ شدید منجر میشود که معمولاً رنگها را به سفید و آبی بسیار کمرنگ کاهش میدهد.[۷]
خاصیت ضدمیکروبی
ویرایشاثر گسترده بیشتر سفیدکنندهها به دلیل واکنش شیمیایی عمومی آنها علیه ترکیبات آلی است، نه به دلیل اثرات مهاری یا سمی انتخابی آنتیبیوتیکها. آنها بسیاری از پروتئینها، از جمله تمام پریونها، را به طور غیرقابل برگشت تغییر شکل داده یا نابود میکنند و این امر آنها را به ضدعفونیکنندههای بسیار چند منظوره تبدیل میکند.
سفیدکنندههای هیپوکلریت در غلظتهای پایین نیز بر باکتریها اثر میگذارند از طریق تداخل با پروتئینهای شوک حرارتی بر روی دیوارههای آنها.[۸] بر اساس گزارش بهداشت و بهداشت خانگی سال ۲۰۱۳، استفاده از سفیدکنندهها، چه مبتنی بر کلر و چه مبتنی بر پراکسید، به طور قابل توجهی کارایی میکروبکشی لباسها را حتی در دماهای پایین (۳۰-۴۰ درجه سانتیگراد) افزایش میدهد، که این امر باعث میشود ویروسها، باکتریها و قارچها از انواع لباسها در محیط خانگی حذف شوند.
فرایند تولید
ویرایشآب ژاول را از دمیدن گاز کلر درمحلول سدیم هیدروکسید تهیه میکنند. از جمله آزمایشهایی که روی آب ژاول انجام میشود تعیین مقدار «کلر آزاد» و تعیین مقدار NaOH است.[۱] «کلر آزاد» در اینجا اصطلاح است، چون در اینجا اکسیدکنندگی ناشی از یون هیپوکلریت است نه گاز کلر. طبق تعریف، «کلر آزاد» یک ترکیب سفیدکننده برابر مقدار کلری است که قدرت اکسیدکنندگیاش معادل قدرت هر مول از ترکیب موردنظر باشد.[۹]
آب ژاول محلولی ناپایدار است و در اثر حرارت و نور به تدریج خاصیت خود را از دست میدهد.
تولید به روش تزریق گاز کلر
ویرایشCl۲ + 2NaOH ----> NaClO + NaCl + H۲O
همانطور که از واکنش بالا پیداست، چنانچه گاز کلر را در محلول سود سوزآور وارد کنید، آب ژاول تولید میشود. تمامی مخازن و لولههای داخل آن که برای تولید مایع سفیدکننده بکار میروند باید از جنس PVC باشند، زیرا گاز کلر در مجاورت با رطوبت با هر فلزی ترکیب میشود؛ و باعث خوردگی آن میشود.
در داخل مخزن سود را میریزند و از پایین گاز کلر را وارد میکنند. میل ترکیبی گاز کلر با سود بسیار زیاد است، به همین دلیل گاز کلر در خلال زمانی که از ته مخزن به سطح مخزن میرسد، جذب میشود.
در اینجاست که هرچه خروجی گاز کلر از سطح مخزن کمتر باشد نشاندهنده این است که واکنش دارد به خوبی صورت میگیرد.
آنچه در رابطه با تهیه آب ژاول به روش فوق اهمیت دارد، دقت در کنترل، به هنگام تولید آن است زیرا چنانچه تزریق کلر قبل از خاتمه عمل متوقف نشود، واکنش برعکس شده و بسرعت دما بالا میرود و محصول از بین میرود. حسگری که اپراتور واحد تولید آب ژاول را در قطع به موقع تزریق گاز کلر یاری میدهد ORP نام دارد و بر اساس اکسایش /کاهش کار میکند.
اگر pH به حدود ۱۲/۲ تا ۱۲ برسد واکنش پایان یافتهاست. از آنجائیکه هرچه محیط سردتر باشد واکنش نیز بهتر صورت میگیرد بایستی دقت شود تا دما از ۴۲ درجه سانتیگراد بالاتر نرود. در یک تولید نرمال، گاز کلر از حدود ۲۰ درجه شروع شده و در دمای ۴۲ درجه پایان میگیرد.[۱۰]ژاول
تاریخچه
ویرایشقدیمیترین شکل سفید کردن شامل پهن کردن پارچهها و لباسها در یک میدان سفیدکاری بود تا توسط نور خورشید و آب، سفید شوند. در قرن هفدهم، صنعت سفید کردن پارچه در اروپای غربی بسیار رونق داشت و از حمامهای قلیایی (معمولاً با استفاده از قلیا) و حمامهای اسیدی (مانند اسید لاکتیک از شیر ترش، و بعدتر اسید سولفوریک رقیق) به صورت متناوب استفاده میشد. کل این فرآیند تا شش ماه طول میکشید.
سفیدکنندههای مبتنی بر کلر که این فرآیند را از ماهها به ساعتها کاهش دادند، در اواخر قرن هجدهم در اروپا اختراع شدند. شیمیدان سوئدی، کارل ویلهلم شیله، کلر را در سال ۱۷۷۴ کشف کرد و در سال ۱۷۸۵، دانشمند سواوی، کلود لویی برتوله، تشخیص داد که میتوان از آن برای سفید کردن پارچهها استفاده کرد. برتوله همچنین هیپوکلریت سدیم را کشف کرد که اولین سفیدکننده تجاری شد و به نام «آب ژاول» نامگذاری شد، به نام منطقه ژاول در نزدیکی پاریس که در آن تولید میشد.
شیمیدان و صنعتگر اسکاتلندی، چارلز تننت، در سال ۱۷۹۸ محلولی از هیپوکلریت کلسیم را به عنوان جایگزینی برای آب ژاول پیشنهاد کرد و در سال ۱۷۹۹ پودر سفیدکننده (هیپوکلریت کلسیم جامد) را به ثبت رساند. حدود سال ۱۸۲۰، شیمیدان فرانسوی، آنتوان ژرمن لا باراک، توانایی ضدعفونی و بوزدایی هیپوکلریتها را کشف کرد و در ترویج استفاده از آنها برای این منظور نقش اساسی داشت. کار او بهبود بزرگی در عملهای پزشکی، بهداشت عمومی و شرایط بهداشتی در بیمارستانها، کشتارگاهها و تمام صنایع مرتبط با محصولات حیوانی ایجاد کرد.
لویی ژاک تنارد در سال ۱۸۱۸ برای اولین بار پراکسید هیدروژن را با واکنش باریوم پراکسید با اسید نیتریک تولید کرد. پراکسید هیدروژن برای اولین بار در سال ۱۸۸۲ برای سفید کردن استفاده شد، اما تا بعد از سال ۱۹۳۰ به اهمیت تجاری نرسید. پربورات سدیم به عنوان سفیدکننده لباس از اوایل قرن بیستم در اروپا استفاده میشد و در دهه ۱۹۸۰ در آمریکای شمالی محبوب شد.
مطالعه بیشتر
ویرایشسوالات متداول پرسیده شده درباره آب ژاول
جستارهای وابسته
ویرایشمنابع
ویرایش- ↑ ۱٫۰ ۱٫۱ دانشگاه علوم پزشکی و خدمات بهداشتی درمانی شیراز بایگانیشده در ۱۲ نوامبر ۲۰۱۱ توسط Wayback Machine بازبینی ۱۷ اسفند ۱۳۸۸
- ↑ دانشگاه علوم پزشکی مشهد بایگانیشده در ۷ سپتامبر ۲۰۱۲ توسط Wayback Machine بازبینی ۱۷ اسفند ۱۳۸۸
- ↑ وبگاه مدیریت بهداشت، ایمنی، محیط زیست و کیفیت شرکت ملی صنایع پتروشیمی بایگانیشده در ۲۶ نوامبر ۲۰۱۰ توسط Wayback Machine بازبینی ۱۷ اسفند ۱۳۸۸
- ↑ فرهنگنامهٔ کودکان و نوجوانان، جلد اول، تهران ۱۳۷۷
- ↑ Mayer, Robert J.; Ofial, Armin R. (2018-05-18). "Nucleophilic Reactivities of Bleach Reagents". Organic Letters. 20 (10): 2816–2820. doi:10.1021/acs.orglett.8b00645. ISSN 1523-7052. PMID 29741385.
- ↑ Field, Simon Q (2006). "Ingredients – Bleach". Science Toys. Retrieved 2 March 2006.
- ↑ Bloomfield, Louis A (2006). "Sunlight". How Things Work Home Page. Archived from the original on 11 May 2013. Retrieved 23 February 2012.
- ↑ Winter, J.; Ilbert, M.; Graf, P. C. F.; Ozcelik, D.; Jakob, U. (2008-11-14). "Bleach activates a redox-regulated chaperone by oxidative protein unfolding". Cell. 135 (4): 691–701. doi:10.1016/j.cell.2008.09.024. ISSN 1097-4172. PMC 2606091. PMID 19013278.
- ↑ Shreve's Chemical Process Industries, McGraw-Hill, 1988, p. 240.
- ↑ «bleach». ویکیپدیا انگلیسی.


