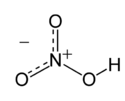
نیتریک اسید
این مقاله به هیچ منبع و مرجعی استناد نمیکند. |
این مقاله نیازمند ویکیسازی است. لطفاً با توجه به راهنمای ویرایش و شیوهنامه، محتوای آن را بهبود بخشید. |
اسید نیتریک یا جوهر شوره با فرمول HNO3 نوعی اسید معدنی بسیار قوی است. ترکیب خالص آن بیرنگ است، اما با گذشت زمان به دلیل تجزیه به اکسیدهای نیتروژن و آب، به مرور زردرنگ میشود.[۲]
| نیتریک اسید | |||
|---|---|---|---|

| |||

| |||
| |||
Nitric acid | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۷۶۹۷-۳۷-۲ | ||
| پابکم | ۹۴۴ | ||
| کماسپایدر | ۹۱۹ | ||
| UNII | 411VRN1TV4 | ||
| شمارهٔ ئیسی | 231-714-2 | ||
| شمارهٔ یواِن | 2031 | ||
| KEGG | D02313 | ||
| MeSH | Nitric+acid | ||
| ChEBI | CHEBI:48107 | ||
| ChEMBL | CHEMBL۱۳۵۲ | ||
| شمارهٔ آرتیئیسیاس | QU5775000 | ||
| 1576 | |||
| 3DMet | B00068 | ||
| جیمول-تصاویر سه بعدی | Image 1 Image 2 | ||
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | H۱N۱O۳ | ||
| جرم مولی | ۶۳٫۰۱ g mol−1 | ||
| شکل ظاهری | Colorless liquid | ||
| چگالی | 1.5129 g cm-3 | ||
| دمای ذوب | −۴۲ درجه سلسیوس (−۴۴ درجه فارنهایت؛ ۲۳۱ کلوین) | ||
| دمای جوش | ۸۳ درجه سلسیوس (۱۸۱ درجه فارنهایت؛ ۳۵۶ کلوین) | ||
| انحلالپذیری در آب | Completely miscible | ||
| اسیدی (pKa) | -1.4 | ||
| ضریب شکست (nD) | 1.397 (16.5 °C) | ||
| گشتاور دوقطبی | 2.17 ± 0.02 D | ||
| ترموشیمی | |||
آنتروپی مولار
استاندارد S |
146 J·mol-1·K-1[۱] | ||
آنتالپی استاندارد
تشکیل ΔfH |
-207 kJ·mol-1[۱] | ||
| خطرات | |||
| MSDS | ICSC 0183 PCTL Safety Website | ||
| شاخص ئییو | ۰۰۷-۰۰۴-۰۰-۱ | ||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۸ R۳۵ | ||
| شمارههای نگهداری | (S1/2) S۲۳ S26 S۳۶ S45 | ||
| لوزی آتش | |||
| نقطه اشتعال | |||
| ترکیبات مرتبط | |||
| دیگر آنیونها | نیتراس اسید | ||
| دیگر کاتیونها | سدیم نیترات شوره آمونیوم نیترات | ||
| ترکیبات مرتبط | دینیتروژن پنتاکسید | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
اسید نیتریک خالص (HNO3) در ۴۱٫۶- درجه سلسیوس ذوب شده، تولید مایع بیرنگی میکند، اما نسبت به درجه حرارت و درجه تابش نور بر آن، گستره رنگ آن از زرد تا قرمز متمایل به قهوهای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
4HNO3 → 2H2O + 4NO2 + O2
به این علت ظرفهای محتوی آن، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با ۱۲۱٫۹ درجه سلسیوس است که شامل ۶۸٫۷٪ وزنی HNO3 میباشد.
اکثر اسید نیتریکهای موجود در بازار غلظتی برابر ۶۸٪ درون آب دارند. این محلول با نقطه جوش ۱۲۰٫۵ درجه سلسیوس در فشار یک اتمسفر میباشد. دو شکل هیدراته برای آن شناخته شدهاست:
- مونوهیدرات (HNO3·H2O)
- تریهیدرات (HNO3·3H2O)
اگر غلظت اسید نیتریک بیشتر از ۸۶٪ شود به آن اسید نیتریک دودزا (به انگلیسی: fuming nitric acid) میگویند.[۲] به اسید نیتریک با غلظت بیش از ۹۵٪ اسید نیتریک دودسفید و به اسید نتیریک با غلظت بیش از ۸۶٪ اسید نیتریک دودقرمز گفته میشود. از این اسیدها به عنوان اکساینده در سوخت راکت استفاده میشود.[۳]
تاریخچه
ویرایشاز اسید نیتریک در سده شانزدهم برای جداسازی طلا از نقره استفاده میشد.
اسید نیتریک را از شوره به دست میآورند؛ بدین طریق که سولفات آهن یا زاج را در حالت گرم روی شوره اثر میدادند. این طریقه تولید نشان میدهد که شوره مصرفی، خالص بودهاست. به ترکیبی از دو ماده، کمی ماسه، آهک یا سفال شکسته میافزودند؛ ماده به دست آمده را در یک شیشه کوچک در دار میریختند. این شیشهها را در کوره آهک پزی میگذاشتند که میتوانست دو ردیف از این شیشهها را که هر ردیف چهار تا شیشه بود دربرگیرد. این شیشهها را تا گردن در خاک یا خاکستر، که سبب پخش گرما و جلوگیری از ترک برداری شیشه میشد، قرار میدادند. از در پوش شیشهها لولههایی خارج میشد که به همین تعداد شیشههای مایع کننده، بر روی سکویی خارج از کوره متصل بودند. همه اتصالات بهدقت آببندی میشدند. حرارت نخست معتدل بود تا ماده خام درون شیشهها خشک شود، سپس هر شش ساعت به شش ساعت حرارت را زیاد میکردند، گازهای نیترو به وسیلهٔ آب تبلور نمکها، به خارج کشیده میشد. هر وقت رنگ محصول تقطیر نشان میداد که تجزیه به پایان رسیدهاست، حرارت را به تدریج کم میکردند.
روش سولفات آهن باز به وسیلهٔ گلاوبِر شرح داده شدهاست. این روش بدون شک تا آغاز سده هجدهم، تنها روش مورد استفاده برای تولید نیتریک اسید بودهاست. انگلیسیها و هلندیها تا مدتها بعد هم از روش سولفات آهن استفاده میکردند؛ اما در فرانسه روش آلومین جای آن را گرفت.
در سده پیش، تولیدکنندگان اسید نیتریک گمان میبردند که بازده تولید با روش آلومین از بازده آن با سولفات آهن کمتر است. کمی پس از آن نظر مخالف غلبه یافت بدون اینکه معلوم شود که برپایه کدام مشاهدات این تغییر عقیده ایجاد شدهاست. بدیهی است که کار آزمایشگاهی در این عمل بی تأثیر بودهاست. محتوای کتابهای شیمی شامل دستورهای نسخه مانندی است که مؤلفان آنها از عمل کنندگان دریافت داشتهاند. گویا تغییرات در روشهای سنتی در نتیجه ایجاد بازار بهتر و تقاضاهای بیشتر بودهاست.
روشهای تهیه اسید نیتریک
ویرایشامروزه در تولید صنعتی اسید نیتریک، آمونیاک به عنوان ماده اولیه استفاده میشود. از نظر تاریخی، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی) بهدست آمد. واکنش در کورههایی با دمای ۱۵۰ تا ۱۷۰ درجه سانتیگراد صورت میگیرد. اسید بهدست آمده، دارای غلظت ۸۳ تا ۸۶ درصد است؛ که به اسید دودکننده معروف است ورنگ این اسید قرمز تا زرد میباشد.
فرایند بریک لند (Birkeland–Eyde process) در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بهدست آورد.
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO، علاوه بر هزینه انرژی الکتریکی، مقداری گاز نیز باید در جریان باشد. ضمناً دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
فرایند استوالد(Ostwald process) نخست تبدیل آمونیاک در حضور اکسیژن یک کاتالیزور مانند پلاتین یا رودیم، حرارت میدهیم تا اکسایش-کاهش انجام شود و اکسید نیتروژن و آب بهدست آید. اکسید نیتروژن دوباره اکسید میشود تا دیاکسید نیتروژن بهدست آید. هنگام کاهش ماده و تبدیل دوبارهٔ آن به اکسید نیتروژن واکنش جذب گاز توسط آب نیز انجام میشود و اسید نیتریک رقیق بهدست میآید و در ادامه با تقطیر به غلظت مطلوب میرسد.
خواص فیزیکی و شیمیایی
ویرایشاسید نیتریک موجود در بازار یک آزوتوپ با آب در غلظت 68% است. این محلول دارای دمای جوش ۱۲۰٫۵ درجه سانتی گراد در ۱ اتمسفر است. به عنوان «اسید نیتریک غلیظ» شناخته میشود. اسید نیتریک غلیظ خالص مایعی بیرنگ در دمای اتاق است.
دو هیدرات جامد شناخته شدهاست: مونوهیدرات (HNO3 · H2O یا [H3O] NO3) و تری هیدرات (HNO3 · 3H2O).
گاهی مقیاس چگالی قدیمی تر دیده میشود، با اسید نیتریک غلیظ مشخص شده به عنوان ۴۲ درجه.
پیوند با نیتروژن دیاکسید
ویرایشنیتریک اسید در معرض تجزیه گرمایی یا نور قرار دارد و به همین دلیل اغلب در بطریهای شیشهای قهوهای ذخیره میشود.
این واکنش ممکن است منجر به تغییرات ناچیز در فشار بخار در بالای مایع شود زیرا اکسیدهای نیتروژن تولید شده بهطور نسبی یا کامل در اسید حل میشوند.
دیاکسید نیتروژن (NO۲) در اسید نیتریک به رنگ زرد یا حتی قرمز در دماهای بالاتر حل میشود. در حالی که اسید خالص به هنگام مواجهه با هوا، گاز سفید را رها میکند، اسید همراه با نیتروژن حلشده، بخار قهوهای مایل به قرمز را رها میکند و منجر به نامهای عامیانه " اسید نیتریک " و " نیتریک اسید خشمگین " میشود. اکسیدهای نیتروژن (اکسیدهای نیتروژن) در نیتریک اسید حل میشوند.
اسیدنیتریک گازدار
ویرایشیک درجه تجاری Fuming nitric acid حاوی 98% HNO3 و چگالی ۱٫۵۰ گرم در سانتیمتر مکعب است. این درجه اغلب در صنایع منفجره استفاده میشود. به اندازه اسید بی آب فرار و خورنده نیست و غلظت تقریبی آن 21.4 M است.
اسید نیتریک بخور دهنده قرمز یا RFNA حاوی مقادیر قابل توجهی دیاکسید نیتروژن محلول (NO2) است که محلول را با یک رنگ قهوه ای مایل به قرمز ترک میکند. به دلیل دیاکسید نیتروژن محلول، تراکم اسید نیتریک بخور دهنده قرمز در ۱٫۴۹۰ گرم در سانتیمتر مکعب کمتر است.
بخار اسید نیتریک مهار شده (یا IWFNA یا IRFNA) میتواند با افزودن ۰٫۶ تا ۰٫۷٪ هیدروژن فلوراید (HF) ساخته شود. این فلوراید برای مقاومت در برابر خوردگی در مخازن فلزی اضافه میشود. فلوراید یک لایه فلورید فلز ایجاد میکند که از فلز محافظت میکند.
اسید نیتریک بدون آب
ویرایشFuming nitric acid سفید، اسید نیتریک خالص یا WFNA، بسیار نزدیک به اسید نیتریک بی آب است. با سنجش به عنوان اسید نیتریک ۹/۹۹ درصد در دسترس است. یکی از مشخصات اسید نیتریک بخور سفید این است که حداکثر ۲٪ آب و حداکثر 0.5% NO2 محلول دارد.
اسید نیتریک بی آب دارای تراکم ۱٫۵۱۳ گرم در سانتیمتر مکعب است و غلظت تقریبی آن ۲۴ مولار است. اسید نیتریک بی آب یک مایع متحرک بیرنگ با تراکم ۱٫۵۱۲ گرم در سانتیمتر مکعب است که در دمای ۴۲- درجه سانتیگراد جامد میشود و بلورهای سفید تشکیل میدهد.
با تجزیه شدن آن به NO2 و آب، رنگ زرد به دست میآورد. در دمای ۸۳ درجه سانتی گراد میجوشد. این ماده معمولاً در یک بطری شیشه ای کهربای ضد شکن و با دو برابر فضای سر نگهداری میشود تا امکان ایجاد فشار فراهم شود، اما حتی با این اقدامات احتیاطی بطری باید ماهانه تخلیه شود تا فشار خارج شود.
ساختار و پیوند
ویرایشدو تا از پیوندهای N-O معادل و نسبتاً کوتاه هستند (این را میتوان با تئوریهای تشدید توضیح داد؛ اشکال متعارف در این دو پیوند شخصیت پیوند دوگانه نشان میدهد و باعث میشود کوتاهتر از پیوندهای معمولی N-O باشند)، و پیوند N-O سوم کشیدهاست زیرا اتم O نیز به یک پروتون متصل است.
کاربرد
ویرایشاصلیترین کاربرد صنعتی اسید نیتریک برای تولید کودها است. اسید نیتریک با آمونیاک خنثی میشود و نیترات آمونیوم میدهد. این برنامه ۷۵–۸۰٪ از ۲۶ میلیون تن تولید سالانه (۱۹۸۷) را مصرف میکند. سایر کاربردهای اصلی برای تولید مواد منفجره، پیش سازهای نایلون و ترکیبات آلی ویژه است.[۴]
پیش ماده ترکیبات آلی نیتروژن
ویرایشدر سنتز آلی، صنعتی و غیره، گروه نیترو یک گروه عملکردی همهکاره است. مخلوطی از اسیدهای نیتریک و سولفوریک با جایگزینی معطر الکتروفیل، یک جایگزین نیترو به ترکیبات مختلف معطر وارد میکند. بسیاری از مواد منفجره مانند TNT به این روش تهیه میشوند:
اسید سولفوریک غلیظ یا اولئوم آب اضافی را جذب میکند.
گروه نیترو را میتوان برای ایجاد یک گروه آمین کاهش داد، اجازه میدهد ترکیبات آنیلین از نیتروبنزنهای مختلف ایجاد شود
استفاده به عنوان اکسید کننده
ویرایشپیش ماده نایلون، اسید آدیپیک، در مقیاس وسیعی توسط اکسیداسیون "روغن KA" - مخلوطی از سیکلوهگزانون و سیکلوهگزانول - با اسید نیتریک تولید میشود.
پیشرانه موشکی
ویرایشاز اسید نیتریک به اشکال مختلف به عنوان اکسید کننده موشکهای دارای سوخت مایع استفاده شدهاست. این اشکال شامل اسید نیتریک بخور دهنده قرمز، اسید نیتریک بخور دهنده سفید، مخلوط با سولفوریک اسید و این اشکال با مهار کننده HF است.[۵] IRFNA (بخار نیتریک اسید مهار شده قرمز) یکی از ۳ جز سوخت مایع موشک BOMARC بود.[۶]
فرآوری فلز
ویرایشاز اسید نیتریک میتوان برای تبدیل فلزات به فرمهای اکسیده مانند تبدیل فلز مس به نیترات مس استفاده کرد. همچنین میتواند در ترکیب با اسید هیدروکلریک به عنوان آبزیان برای حل شدن فلزات نجیب مانند طلا (به عنوان اسید کلروآوریک) استفاده شود. از این نمکها میتوان برای فرایند تبلور مجدد و نزولات انتخابی برای تصفیه طلا و سایر فلزات فراتر از خلوص ۹۹٫۹٪ استفاده کرد.
معرف تحلیلی
ویرایشدر تجزیه و تحلیل اولیه توسط ICP-MS , ICP-AES , GFAA و Flame AA، از اسید نیتریک رقیق (۰٫۵–۵٫۰ .۰) به عنوان یک ترکیب ماتریس برای تعیین محلولهای ردیابی فلز استفاده میشود. برای چنین تعیینی، اسید ردیابی فلز فوقالعاده خالص مورد نیاز است، زیرا مقادیر کمی از یونهای فلزی میتواند نتیجه آنالیز را تحت تأثیر قرار دهد. همچنین بهطور معمول در فرایند هضم نمونههای آب کدر، نمونههای لجن، نمونههای جامد و همچنین انواع دیگر نمونههای منحصر به فرد که به تجزیه و تحلیل اساسی از طریق ICP-MS , ICP-OES , ICP-AES , GFAA و طیفسنجی جذب اتمی شعله نیاز دارند، استفاده میشود. . بهطور معمول در این هضمها از محلول 50% HNO خریداری شده استفاده میشود ۳ مخلوط با نوع 1 DI آب.
در الکتروشیمی، از اسید نیتریک به عنوان ماده شیمیایی دوپینگ برای نیمه هادیهای آلی و در فرآیندهای تصفیه برای نانولولههای کربن خام استفاده میشود.
نجاری
ویرایشدر غلظت کم (تقریباً ۱۰٪)، اسید نیتریک اغلب برای پیر شدن مصنوعی کاج و افرا استفاده میشود. رنگ تولید شده یک طلای خاکستری است و بسیار شبیه چوبهای بسیار قدیمی موم یا روغن (اتمام چوب) است.
عامل اچ و تمیز کننده
ویرایشاز اثرات خورنده اسید نیتریک برای برخی از کاربردهای خاص مانند قلم زنی در چاپ، ترشی فولاد زنگ نزن یا تمیز کردن ویفرهای سیلیکونی در الکترونیک استفاده میشود.[۷]
از محلول اسید نیتریک، آب و الکل، نیتال، برای حکاکی فلزات استفاده میشود تا ریز-ساختار ها را آشکار کند. ISO 14104 یکی از استانداردهایی است که جزئیات این روش کاملاً شناخته شده را بیان میکند. اسید نیتریک یا در ترکیب با اسید کلریدریک یا به تنهایی برای تمیز کردن لغزشهای شیشه ای و سرسرههای شیشه ای برای کاربردهای میکروسکوپ پیشرفته استفاده میشود.[۸] همچنین برای تمیز کردن شیشه قبل از نقره سازی هنگام ساخت آینههای نقره استفاده میشود. مخلوطهای آبی موجود در بازار از ۵–۳۰٪ اسید نیتریک و ۱۵–۴۰٪ اسید فسفریک معمولاً برای تمیز کردن مواد غذایی و تجهیزات لبنی در درجه اول برای از بین بردن رسوبات کلسیم و منیزیم استفاده میشود (یا از جریان فرایند رسوب میکند یا ناشی از استفاده از آب سخت در هنگام تولید و تمیز کردناست)
. محتوای اسید فسفریک به غیرفعال شدن آلیاژهای آهن در برابر خوردگی توسط اسید نیتریک رقیق کمک میکند.
اسید نیتریک میتواند به عنوان یک آزمایش لکه ای برای آلکالوئیدها مانند LSD مورد استفاده قرار گیرد و بسته به آلکالوئید رنگهای متنوعی را ایجاد میکند.
واکنش با مواد مختلف
ویرایشواکنش با سولفوریک اسید
ویرایشنیتریک اسید در واکنش با سولفوریک اسید یک اسید قوی تولید میکند که در این فرایند یون نیترونیوم فعال نیز آزاد میشود که در ترکیب با مواد آلی، مواد منفجره قوی نظیر تیانتی و نیتروگلیسیرین و… تولید میکند .(فرایند نیتراسیون). یکی از مهمترین واکنشهای نیتریک اسید واکنش آن با گلیسیرین که باعث تولید نیتروگلیسیرین میشود.
HNO3 + 2H2SO4 ⇌ NO2+ + H3O+ + 2HSO4−; K ~ ۲۲
یکی از کاربردهای آن در صنعت، استفاده از آن برای پولیش کاری ورقهای فولاد ضدزنگ ۳۰۴ است، که از اسید نیتریک در ترکیب با آب و دی اکساید تیتانیوم استفاده میشود.
ایمنی
ویرایشاسید نیتریک یک اسید خورنده و یک ماده اکسید کننده قوی است. خطر عمده ناشی از آن سوختگیهای شیمیایی است، زیرا هیدرولیز اسید را با پروتئین (آمید) و چربیها (استر) انجام میدهد، در نتیجه بافت زنده (به عنوان مثال پوست و گوشت) تجزیه میشود. اسید نیتریک غلیظ به دلیل واکنش آن با کراتین، پوست انسان را زرد رنگ میکند. این لکههای زرد در هنگام خنثی شدن نارنجی میشوند. اثرات سیستمیک بعید است و این ماده سرطانزا یا جهشزا محسوب نمیشود.
روش درمانی کمک اولیه اولیه برای ریختن اسید بر روی پوست، مانند سایر عوامل خورنده، آبیاری با مقادیر زیادی آب است. شستشو به مدت حداقل ۱۰–۱۵ دقیقه برای خنک شدن بافت اطراف سوختگی اسیدی و جلوگیری از آسیب ثانویه ادامه دارد. لباسهای آلوده بلافاصله برداشته میشوند و پوست زیر کاملاً شسته میشود.
اسید نیتریک به عنوان یک ماده اکسید کننده قوی، میتواند با ترکیباتی مانند سیانیدها، کاربیدها یا پودرهای فلز بهطور انفجار و با بسیاری از ترکیب آلی، مانند سقز، به شدت و بیش از حد (مثلاً با خود اشتعال) واکنش نشان دهد. از این رو، باید دور از پایهها و مواد آلی ذخیره شود.
جستارهای وابسته
ویرایشمنابع
ویرایش- ↑ ۱٫۰ ۱٫۱ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 0-618-94690-X.
- ↑ ۲٫۰ ۲٫۱ "Nitric acid". Wikipedia (به انگلیسی). 2019-11-09.
- ↑ "Red fuming nitric acid". Wikipedia (به انگلیسی). 2019-09-25.
- ↑ Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (2000). "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry.
- ↑ Clark, John D (1972). Ignition!. Rutgers University Press
- ↑ «"BOMARC Summary". BILLONY.COM. Retrieved 2009-05-28».
- ↑ Muraoka, Hisashi (1995) "Silicon wafer cleaning fluid with HNO3, HF, HCl, surfactant, and water
- ↑ Fischer, A. H. ; Jacobson, K. A. ; Rose, J. ; Zeller, R. (1 May 2008). "Preparation of Slides and Coverslips for Microscopy". Cold Spring Harbor Protocols. 2008 (6): pdb.prot4988.