تمایز سلولی
دِگَرسانِش یاختهای یا تَمایُز یاختهای (Cellular differentiation) فرآروندی است که طی آن یاختهها از نظر ویژگیهای عملکردی به سطح بالاتری گذار میکنند. عملیات «دگرسانش» در طول رشد و نمو یک جاندار پریاخته (از تخمک بارورشدۀ تکیاختهای به سامانهای پیچیده از یاختهها و بافتهای گوناگون) بارها صورت میگیرد.
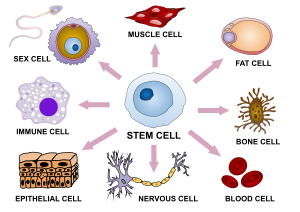
در زیستشناسی تکوینی، دگرسانش یاختهای فرآروندی است که یک یاخته از یک گونه به گونهای دیگر تغییر میکند.[۱][۲] بیشتر یک یاخته به گونهای ویژهیافتهتر تغییر میکند. فراروند دگرسانش چندین بار در درازای تکوین یک جاندار پریاختهای که از یک زیگوت (یاختۀ زاگ) ساده به یک سامانۀ پیچیده از گونههای بافتها و یاختهها تغییر میکند، رخ میدهد. دگرسانش در درازای دوران بزرگسالی همچنان ادامه پیدا میکند. برخی از دگرسانش ها در پاسخ به برخورد با پادگن رخ میدهند. دگرسانش به طرز چشمگیری باعث تغییر اندازه، شکل، پتانسیل غشا، فعالیت سوختوسازی و پاسخدهی به نشالها (سیگنالها) در یاخته میشود. این دگرگونیها بیشتر ناشی از دیسشهای (رفورم) بسیار مهار شده در بیان ژن و موضوع مطالعه در اپیژنتیک (epigenetics) استند. با چند استثنا، دگرسانش یاختهای خود به تنهایی هرگز باعث دگرش در زنجیرۀ DNA نمیگردد؛ بنابراین، یاختههای گوناگون میتوانند ویژگیهای فیزیکی بسیار متفاوتی داشته باشند با وجودی که ژنگان یکسانی دارند.
سطوح مختلفی از توانایی یاخته برای دگرسانش به گونههای دیگر یاخته، وجود دارد. یاختهای که میتواند به همهٔ انواع یاختهها، از جمله بافت جفتی دگرسانش یابد، با عنوان همهتَوان (totipotent) شناخته میشود. در پستانداران، تنها یاختۀ زاگ و بلاستومرهای پس از آن همهتواناند، در حالی که در گیاهان بسیاری از یاختههای دگرسانشیافته میتوانند با تکنیکهای سادهٔ آزمایشگاهی همهتوان شوند. یاختهای که میتواند به همهٔ گونههای یاخته از یک جاندار بزرگسال دگرسانش یابد، پُرتوان (pluripotent) نامیده میشود. چنین یاختههایی در گیاهان رده بالاتر یاختههای مریستماتیک (meristematic) و در جانداران یاختههای بنیادی رویانی (embryonic stem cells) نامیده میشوند، هر چند برخی گروهها حضور یاختههای همهتوان بزرگسال را گزارش میدهند.
القای بیان چهار عامل رونویسی Oct4، Sox2، c-Myc و Kfl4 (عوامل Yamanaka) از راه ویروس برای ایجاد یاختههای پرتوان القایی (iPS) از فیبروبلاستهای بزرگسال بسنده است.[۳]
یک یاختۀ چندتوان (multipotent)، یاختهای است که میتواند به چندین یاختۀ گوناگون اما مرتبط به هم دگرسانش یابد. یاختههای کمتوان (Oligopotent)، بسیار محدودتر از یاختههای چندتوان اند، اما هنوز هم میتوانند به شمار کمی از گونۀ یاختههای مرتبط به هم دگرسانش یابند. در پایان، یاختههای تکتوان (unipotent) استند که تنها میتوانند به یک گونه یاخته دگرسانش یابند، اما توانایی خودنوزایی (self-renewal) دارند.[۴] در یاختهآسیبشناسی (cytopathology)، سطح دگرسانش یاختهای به عنوان یک شاخص اندازهگیری پیشرفت سرطان مورد استفاده قرار میگیرد. درجۀ (Grade) رشد سرطان نشانگر میزان دگرسانش یک یاخته در یک تومور است.[۵]
گونههای یاختههای پستانداران
ویرایشسه دستهٔ اصلی از یاختهها، بدن پستانداران را تشکیل میدهند:
یاختههای زایا (germ cells)،
یاختههای پیکری (somatic cells)
و یاختههای بنیادی (stem cells).
هر یک از حدود ۱۰۰ تریلیون (۱۰۱۴) یاخته در یک انسان بزرگسال دارای رونوشت (کپی) یا رونوشتهای خود از ژنگان است به جز گونههای ویژهای از یاختهها، مانند یاختههای سرخ خون، که بدون هسته در حالت کاملاً دگرسانش خود میباشند. بیشتر یاختهها دولاد (diploid) استند که دو رونوشت از هر کروموزوم دارند. این یاختههای پیکری، بیشتر بدن انسان را تشکیل میدهند، مانند یاختههای پوستی و ماهیچهای. یاختهها دگرسانش مییابند تا برای عملکردهای متفاوت، متخصص و کارشناس شوند.[۶]
یاختههای ردهٔ زایا، رده ای از یاختهها میباشند که به گامتها (تخمکها و اسپرم) دگرسانش مییابند و بدین سان در طی نسلها باقی میمانند. از طرف دیگر، یاختههای بنیادی توانایی دارند تا برای دورههای بیکران بخش شوند و به یاختههای ویژهمند دگرسانش پیدا کنند.
تکوین زمانی آغاز میشود که یک اسپرم، تخمک را بارور میکند و یاختهای یکتا را ایجاد میکند که توانایی تشکیل یک جاندار کامل را دارد. در نخستین ساعات پس از بارورش، این یاخته به یاختههای کاملاً مشابه تقسیم میشود. در انسانها، تقریباً چهار روز پس از بارورش و بعد از چندین چرخهٔ تقسیم یاختهای، این یاختهها آغاز به ویژهمند شدن میکنند، و یک کُرهٔ توخالی از یاختهها به نام بلاستوسیست (blastocyst) را شکل میدهند.[۷] بلاستوسیست یک لایهٔ بیرونی از یاختهها را دارد، و درون این کرهٔ توخالی، دسته ای از یاختهها به نام تودهٔ یاختهای درونی (inner cell mass) قرار دارد.
یاختههای تودهٔ یاختهای درونی عملاً همهٔ بافتهای بدن انسان را شکل دهند. اگرچه یاختههای تودهٔ یاختهای درونی میتوانند عملاً هر گونه یاختهای را که در بدن انسان یافت میشود، تشکیل دهند، آنها نمیتوانند یک جاندار را ایجاد کنند. این یاختهها به عنوان پرتوان شناخته میشوند.[۸]
یاختههای بنیادی پرتوان دچار ویژهمندی بیشتری میشوند و به یاختههای پیشساز چندتوان (multipotent progenitor cells) تبدیل میشوند که سپس این یاختهها به یاختههای عملکردی تبدیل میگردند. نمونههایی از یاختههای بنیادی و پیشساز عبارتند از:
- یاختههای گلیایی شعاعی (radial glial cells) (یاختههای بنیادی عصبی رویانی) که به نورونهای تحریکی در مغز جنین در طی فراروند عصبزایی تبدیل میشوند.[۹][۱۰][۱۱]
- یاختههای بنیادی خونساز (hematopoietic stem cells) (یاختههای بنیادی بزرگسال) از مغزِ استخوان که باعث ایجاد گویچههای سرخ و سفید و پلاکتها میشوند.
- یاختههای بنیادی مزانشیمی (mesenchymal stem cells) (یاختههای بنیادی بزرگسال) از مغز استخوان که باعث ایجاد یاختههای استروما (stromal cells)، یاختههای چربی و گونههایی از یاختههای استخوانی میشوند.
- یاختههای بنیادی پوششی (epithelial stem cells) (یاختههای پیشساز) که گونه های گوناگونی از یاختههای پوستی را تولید میکنند.
- یاختههای ماهوارهای ماهیچه (muscle satellite cells) (یاختههای پیشساز) که در دگرسانش بافت ماهیچهای همکاری میکنند.
مسیری که توسط مولکولهای چسبندهای که شامل چهار آمینواسید آرژنین، گلایسین، آسپارژین و سرین میباشد، هدایت میشود به عنوان بلاستومر یاختهای نامیده میشود. این بلاستومر از یک بلاستولای تکلایهای به سه لایهٔ آغازین یاختههای زایا (germ cells) در پستانداران به نامهای اکتودرم (ectoderm)، مزودرم (mesoderm) و اندودرم (endoderm) (به ترتیب از نزدیکترین (بیرونی) به دورترین (درونی) لایه) دگرسانش مییابد. در پایان اکتودرم منجر به تشکیل پوست و دستگاه عصبی میشود، مزودرم استخوانها و بافت ماهیچهای را تشکیل میدهد و اندودرم بافتهای اندامهای درونی را شکل میدهد.
در مگس سرکه، ریختزاها به دو دسته بخش میشوند:
- ژنهای کارکرد زاگی (به انگلیسی: Zygotic acting)
- ژنهای اثر مادری (به انگلیسی: Maternal effect)
ریختزاهای دستهٔ دوم توسط ۱۵ سلول پرستار که اطراف تخمک در هنگام تخمکزایی (Oogenesis) قرار دارند با شیب ویژهای در تخمک قرار میگیرند. این یاختههای پرستار توسط دریچههای حلقوی با تخمک ارتباط دارند. در اطراف این مجموعۀ ۱۶ یاختهای حدود ۱۰۰۰ یاختۀ فولیکولی قرار دارد. یکی از کارکردهای این یاختههای فولیکولی ایجاد پوستهٔ تخم است.
یاختۀ زاگ (زیگوت) درآغاز بلاستودرم (Blastoderm) را تشکیل میدهد و سپس با ایجاد فرورفتگی به گاسترولا (Gastrula) تبدیل میشود. در گاسترولا دو فرورفتگی به نامهای شیار سر (cephalic furrow) و شیار شکمی (ventral furrow) وجود دارند.
دگرسانش یاختههای بنیادی
ویرایشروشهای مرسوم در دگرسانش یاختههای بنیادی در محیط برونتنی شامل استفاده از شماری مولکولهای گوناگون واسطه به عنوان مثال مولکولهای کوچک یا فاکتورهای رشد میباشد.[۱۲]
برای نمونه پوشش نانوفیبرها با فسفات کلسیم باعث دگرسانش یاختههای مزانشیمی انسانی به سمت استخوان خواهد شد. از طرف دیگر مشخص شدهاست که یاختههای بنیادی به سیگنالهای فیزیکی محیط پیرامون نیز حساس استند. یاختههای مزانشیمی میتوانند بر اساس هندسه سطح در مسیر دگرسانش به دو دودمان یاختهای شامل یاختههای چربی یا استخوان قرار گیرند. تغییر در هندسه سطح در تنظیم اسکلت یاخته و چسبندگی موضعی یاخته با اعمال محدودیت بر روی پهن شدگی یاختهای و در پایان تأثیر بر روی مسیرهای نشال (سیگنال) یاختهای باعث دگرسانش یاختههای بنیادی میشود. برای نمونه بسترهای نانوفیبری که به صورت موازی ریسیده شده در مقایسه با بسترهای نانوفیبری که به صورت درهم ریسیده شدهاست تمایز یاختههای C17.2 تأثیر بیشتری داشتهاست. پژوهش های دیگری نشان دادهاست که سختی سطح، تحریکهای الکتریکی و … نیز بر دگرسانش یاختههای بنیادی اثر خواهد داشت.[۱۳][۱۴][۱۵]
منابع
ویرایش- ↑ 2. Slack, J.M.W. (2013) Essential Developmental Biology. Wiley-Blackwell, Oxford.
- ↑ 3. Slack, J.M.W. (2007). "Metaplasia and transdifferentiation: from pure biology to the clinic". Nature Reviews Molecular Cell Biology. 8 (5): 369–378. PMID 17377526. doi:10.1038/nrm2146.
- ↑ 4. Takahashi, K; Yamanaka, S (2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell. 126 (4): 663–76. PMID 16904174. doi:10.1016/j.cell.2006.07.024.
- ↑ 5. Schöler, Hans R. (2007). "The Potential of Stem Cells: An Inventory". In Nikolaus Knoepffler; Dagmar Schipanski; Stefan Lorenz Sorgner. Humanbiotechnology as Social Challenge. Ashgate Publishing. p. 28. ISBN 978-0-7546-5755-2.
- ↑ 6. "NCI Dictionary of Cancer Terms". National Cancer Institute. Retrieved 1 November 2013.
- ↑ 7. Lodish, Harvey (2000). Molecular Cell Biology (4th ed.). New York: W. H. Freeman. Section 14.2. ISBN 0-7167-3136-3.
- ↑ 8. Kumar, Rani (2008). Textbook of Human Embryology. I.K. International Publishing House. p. 22. ISBN 9788190675710.
- ↑ 9. D. Binder, Marc; Hirokawa, Nobutaka; Windhorst, Uwe (2009). Encyclopedia of Neuroscience. Springer. ISBN 3-540-23735-6.
- ↑ 10. Rakic, P (October 2009). "Evolution of the neocortex: a perspective from developmental biology". Nature Reviews. Neuroscience. 10 (10): 724–35. PMC 2913577. PMID 19763105. doi:10.1038/nrn2719.
- ↑ 11. Lui, JH; Hansen, DV; Kriegstein, AR (8 July 2011). "Development and evolution of the human neocortex.". Cell. 146 (1): 18–36. PMC 3610574. PMID 21729779. doi:10.1016/j.cell.2011.06.030.
- ↑ 12. Rash, BG; Ackman, JB; Rakic, P (February 2016). "Bidirectional radial Ca(2+) activity regulates neurogenesis and migration during early cortical column formation.". Science advances. 2 (2): e1501733. PMC 4771444. PMID 26933693. doi:10.1126/sciadv.1501733.
- ↑ Trepat, X. , et al. : Universal physical responses to stretch in the living cell. Nature 447(7144), 592 595 (2007)
- ↑ Jakkaraju, S. , Zhe, X. , Schuger, L. : Role of stretch in activation of smooth muscle cell lineage. Trends Cardiovasc. Med. 13(8), 330 335 (2003)
- ↑ Serena, E. , et al. : Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Exp. Cell Res. 315(20), 3611 3619 (2009)
- ↑ Yamada, M. , et al. : Electrical stimulation modulates fate determination of differentiating embryonic stem cells. Stem Cells 25(3), 562 570 (2007)
زیرنویس
ویرایش- ^ Zygote