سلول بنیادی جنینی
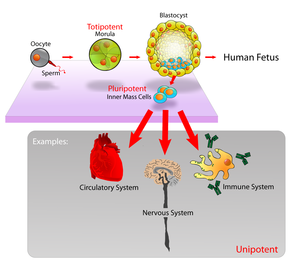
یاختههای بنیادی رویانی (به انگلیسی: Embryonic stem cell)، یا (ایاس ES) بنیاختههایی هستند که از تودهٔ یاختهای درونی بلاستوسیستِ یک مرحلۀ ابتدایی رویانی پیش از لانهگزینی، به دست میآیند.[۱][۲] رویان انسان در ۴ تا ۵ روز بعد از بارورش به مرحلهٔ بلاستوسیست میرسد؛ که در آن زمان آنها از ۵۰ تا ۱۵۰ یاخته تشکیل شدهاند.
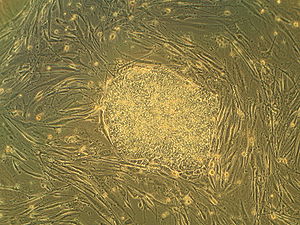
منزویساختن رویانتَنده (embryoblast) یا تودهٔ یاختهای درونی (آیسیام ICM) به تخریب بلاستوسیست منجر میشود، که به مطرحشدن مسائل اخلاقی، از جمله این که آیا رویان در مرحلهٔ پیشکاشت باید از نظر وضعیت اخلاقی یا حقوقی، به همان صورت وجود توسعهیافتهتر انسان در نظر گرفتهشود یا نه، میانجامد.[۳][۴]
یاختههای بنیادی رویانی انسان اندازهای کم و بیش نزدیک به ۱۴ میکرومتر دارند در صورتی که یاختههای بنیادی رویانی موش به ۸ میکرون نزدیکتر است.[۵]
ویژگیها
ویرایشیاختههای بنیادی رویانی، از مرحلهٔ نخستِ بلاستوسیستِ رویانِ پستانداران به دست میآیند، استعداد و توانایی آنها به تمایز و تبدیل به هر گونه یاخته، و توان آنها برای انتشار و زادآوری، ویژه و چشمگیر است. ویژگیهای یاختههای بنیادی رویانی شامل داشتن کاریوتیپ معمول، حفظ فعالیت تلومرازی بالا، و نمایش قابل توجه و بلند مدت توان تکثیر میباشد.[۶]
پرتوانی
ویرایشیاختههای بنیادی رویانی حاصل از تودۀ یاختهای درونی، پرتوان بوده، میتوانند تمایز یافته و اکتودرم ابتدایی را تولید کنند که در نهایت در طول گاسترولاسیون به همه اجزای سه لایۀ جوانه شامل اکتودرم، مزودرم و اندودرم تمایز مییابند. این سه لایه بیشتر از ۲۲۰ گونه یاخته را در بدن بزرگسالان تشکیل میدهند.
به عبارتی یاختههای بنیادی رویانی از یاختههای بنیادی بالغ که در بزرگسالان وجود دارند، توسط خاصیت پرتوانی متمایز میشوند. در حالی که، یاختههای بنیادی رویانی میتوانند انواع یاختهها را ایجاد کنند، یاختههای بنیادی بزرگسال چندتوان بوده و میتوانند تنها تعداد محدودی از انواع یاختهای را تولید کنند.
چنانچه بتوانیم پتانسیل پرتوانی یاختههای بنیادی رویانی (تمایز به انواع یاختهها) را به صورت برون تنی تحت کنترل درآوریم ممکن است بتوان از این یاختهها به عنوان وسیلهای برای ایجاد انواع یاختهها یا انواع بافتهای مورد نیاز استفاده کرد در این صورت یک روش درمانی جدید برای دامنه وسیعی از عوامل آسیبرسان به بافتها همچون افزایش سن، برخی بیماریها یا آسیبهایی که منجر به صدمه بافتی میشوند، فراهم میسازد.
تکثیر
ویرایشیاختههای بنیادی رویانی قادرند تحت شرایط مشخصی به شکل نامحدود و به صورت تمایز نیافته تکثیر شوند چنین ظرفیتی تا زمان دریافت پیامهایی که حاکی از فراهم بودن شرایط تمایز است، ادامه مییابد.[۷] این قدرت تکثیر به یاختههای بنیادی رویانی اجازه میدهد که به عنوان ابزاری مفید برای پژوهشها و پزشکی بازساختی استفاده شوند.
فایدهها
ویرایشبه دلیل انعطافپذیری و ظرفیت نامحدود و بالای خودنوزایی این یاختهها، درمان با استفاده از یاختههای بنیادی رویانی برای پزشکی بازساختی و جایگزینی بافتها پس از جراحت بافتها یا بیماری مطرح شده است.
بیماریهای همچون برخی از بیماریهای ژنتیکی مرتبط با دستگاه ایمنی و خون، سرطانها و اختلالها، دیابت کودکی، پارکینسون، کوری و آسیبیهای نخاعی از جمله بیماریهایی هستند که به شکل بالقوه به وسیلهٔ یاختههای بنیادی پرتوان درمان شدهاند.
علاوه بر نگرانیهای اخلاقی موجود در ارتباط با درمان با استفاده از یاختههای بنیادی، مشکلات فنی مرتبط با رد پیوند یاختههای بنیادی آلوژنیک در میزبان نیز وجود دارد. با این حال مشکلات مرتبط با سازگاری بافتی را ممکن است بتوان با استفاده از یاختههای بنیادی بزرگسال دهندۀ اتولوگ یا همسانهدرمانی حل نمود. از دیگر کاربردهای بالقوه یاختههای بنیادی رویانی میتوان به امکان بررسی مراحل اولیۀ تکوین انسان، مطالعه بیماریهای ژنتیکی و مطالعات سمشناسی اشاره نمود.[۸]
کاربردها
ویرایشکاربردهای بالقوه در استفادههای بالینی
ویرایشطبق یک مقاله ۲۰۰۲ در PNAS، یاختههای بنیادی رویانی انسان پتانسیل تمایز به انواع مختلف از یاختهها را دارند و بنابراین ممکن است به عنوان یک منبع یاختهای برای پیوند زدن یا مهندسی بافت مفید باشند.[۹]
پژوهشهای حاضر بر روی تمایز ES به دامنه وسیعی از انواع یاختهها برای درمانهای جایگزین سلولی متمرکز شدهاند. کاردینومیستها (CM)، نورونها، یاختههای جگری، یاختههای مغزِ استخوان، یاختههای جزیرهای و یاختههای اندوتلیال از جمله یاختههایی هستند که از طریق تمایز یاختههای بنیادی رویانی بدست آمدهاند.[۱۰] با این حال اشتقاق چنین یاختههایی از ESCs بدون مانع نبوده و از این رو تحقیقات حاضر بر روی غلبه بر این موانع متمرکز شدهاند.[۱۱]
مطالعات انجام شده در زمینهٔ سمشناسی نشان دادهاند که کاردیومیستهای مشتق شده از ES مدلهای برون تنی منبع معتبری برای سنجش پاسخهای دارویی و پیشبینی پروفایل محرکهای دارویی بوده و از این رو میتوانند برای ارزیابی سمیتهای قلبی استفاده شوند.[۱۲] همچنین یاختههای جگری مشتق شده از ES مدلهای مفیدی هستند که توانستهاند در مراحل پیشبالینی کشف دارو استفاده شوند.
پژوهشگران همچنین بر روی تمایز ES به یاختههای تولیدکننده دوپامین به امید استفاده از این نورونها در درمان بیماری پارکینسون متمرکز شدهاند.[۱۳][۱۴]
بهتازگی، نیز توسعه ESهای حاصل از انتقال هستۀ یاختۀ پیکری یاختههای غلافدارشده بویایی به یک تخمک سالم برای بیماریهای تحلیل برنده اعصاب استفاده میشود.[۱۵] همچنین ESها میتوانند به یاختههای کشنده طبیعی و مغز استخوان تمایز یابند.[۱۶] استفاد دیگر از ESها برای ارائه درمان جایگزین دیابت است.[۱۷]
یاختههای بنیادی رویانی انسانی به عنوان مدل اختلالهای ژنتیکی
ویرایشدر این زمینه مطالعات متعددی انجام شده است. مطالعات به وسیلهٔ دستورزی ژنتیکی یاختهها یا به وسیلهٔ استخراج ردههای یاختهای بیمار که با بررسی ژنتیکی یاختهها پیش از تولد شناسایی شدهاند صورت میگیرد.
دانشمندان تکنیک جدیدی برای استخراج یاختههای بنیادی رویانی انسان، ردههای ESC نرمال از منابع مختلف رویانی شامل موروبلاستها کشف کردهاند. این یافتهها به پژوهشگران اجازه میدهد که ردۀ ESC را از رویانهایی که اختلالهای ژنتیکی متعددی دارند ساخته و بدین ترتیب به تشخیص در سطح مولکولی سازوکارهای مسدود شده و عامل بیماری دست یابند. چنین ردههایی که از رویانهایی با ناهنجاریهای کروموزومی و ژنتیکی سرچشمه میگیرند، اطلاعات مفیدی را برای فهم مسیرهای منجر به نقصهای ژنتیکی فراهم میسازند.[۱۸]
ترمیم آسیبهای DNA
ویرایشبه دلیل اینکه یاختههای ES میتوانند به انواع یاختههای یک جاندار تبدیل شوند جهش و معیوب شدن DNA در این یاختهها یک مشکل جدّی خواهد بود، بنابراین سازوکارهای متعددی برای ترمیم خسارتهای وارد شده به DNA در چنین یاختههایی وجود دارد.[۱۹]
اثرهای منفی یاختههای بنیادی رویانی
ویرایشبا توجه به قدرت تکثیر بالای این یاختهها، نگرانی اصلی در مورد پیوند ES به بیماران برای درمان، توانایی آنها برای تشکیل تومور از جمله تروما است.[۲۰] راهکار اصلی برای افزایش ایمنی ESC در کاربردهای بالینی بالقوه تمایز دادن یاختهها به انواع یاختههای خاص (برای نمونه یاختههای جگری) است که توانایی ایجاد تومور را کاهش یا حذف میکند.[۲۱]
جستارهای وابسته
ویرایشمنابع
ویرایش- ↑ Thomson; Itskovitz-Eldor, J; Shapiro, SS; Waknitz, MA; Swiergiel, JJ; Marshall, VS; Jones, JM (1998). "Blastocysts Embryonic Stem Cell Lines Derived from Human". Science. 282 (5391): 1145–1147. doi:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ "NIH Stem Cell Basics. What are embryonic stem cells?". Archived from the original on 31 August 2016. Retrieved 9 June 2017.
- ↑ Baldwing A (2009). "Morality and human embryo research. Introduction to the Talking Point on morality and human embryo research". EMBO Reports. 10 (4): 299–300. doi:10.1038/embor.2009.37. PMC 2672902. PMID 19337297.
- ↑ Nakaya, Andrea C. (August 1, 2011). Biomedical ethics. San Diego, CA: ReferencePoint Press. pp. 96. ISBN 1-60152-157-X.
- ↑ Thomson, James A.; Zwaka (10 February 2003). "Homologous recombination in human embryonic stem cells". Nature Biotechnology. 21 (3): 319–321. doi:10.1038/nbt788. PMID 12577066.
- ↑ Thomson, J. A.; Itskovitz-Eldor, J; Shapiro, S. S.; Waknitz, M. A.; Swiergiel, J. J.; Marshall, V. S.; Jones, J. M. (1998). "Embryonic Stem Cell Lines Derived from Human Blastocysts". Science. 282 (5391): 1145–7. doi:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ 7. Ying; Nichols, J; Chambers, I; Smith, A (2003). "BMP Induction of Id Proteins Suppresses Differentiation and Sustains Embryonic Stem Cell Self-Renewal in Collaboration with STAT3". Cell. 115 (3): 281–292. doi:10.1016/S0092-8674(03)00847-X. PMID 14636556.
- ↑ 6. ^ Thomson, J. A. ; Itskovitz-Eldor, J; Shapiro, S. S. ; Waknitz, M. A. ; Swiergiel, J. J. ; Marshall, V. S. ; Jones, J. M. (1998). "Embryonic Stem Cell Lines Derived from Human Blastocysts". Science. 282 (5391): 1145–7. doi:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ 8. Levenberg, S. (2002). "Endothelial cells derived from human embryonic stem cells". Proceedings of the National Academy of Sciences. 99 (7): 4391–4396. doi:10.1073/pnas.032074999.
- ↑ 9. ^ :a b Davila, JC; Cezar, GG; Thiede, M; Strom, S; Miki, T; Trosko, J (2004). "Use and application of stem cells in toxicology". Toxicological Sciences. 79 (2): 214–23. doi:10.1093/toxsci/kfh100. PMID 15014205.
- ↑ 10. Siu, CW; Moore, JC; Li, RA (2007). "Human embryonic stem cell-derived cardiomyocytes for heart therapies". Cardiovascular & Hematological Disorders Drug Targets. 7 (2): 145–52. doi:10.2174/187152907780830851. PMID 17584049.
- ↑ 11. Jensen, J; Hyllner, J; Björquist, P (2009). "Human embryonic stem cell technologies and drug discovery". Journal of Cellular Physiology. 219 (3): 513–9. doi:10.1002/jcp.21732. PMID 19277978.
- ↑ 13. Parish, CL; Arenas, E (2007). "Stem-cell-based strategies for the treatment of Parkinson's disease". Neuro-degenerative Diseases. 4 (4): 339–47. doi:10.1159/000101892. PMID 17627139.
- ↑ 12. Perrier, A. L. (2004). "Derivation of midbrain dopamine neurons from human embryonic stem cells". Proceedings of the National Academy of Sciences. 101 (34): 12543–12548. doi:10.1073/pnas.0404700101.
- ↑ 14. Abdul Mannan Baig, Designer’s Microglia with Novel delivery system in Neurodegenerative Diseases. Medical Hypotheses (Impact Factor: 1.18). 08/2014; DOI: 10.1016/j. May. 2014.08.003
- ↑ 15. Waese, EY; Kandel, RA; Stanford, WL (2008). "Application of stem cells in bone repair". Skeletal Radiology. 37 (7): 601–8. doi:10.1007/s00256-007-0438-8. PMID 18193216.
- ↑ 16. d'Amour, KA; Bang, AG; Eliazer, S; Kelly, OG; Agulnick, AD; Smart, NG; Moorman, MA; Kroon, E; Carpenter, MK; Baetge, EE (2006). "Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells". Nature Biotechnology. 24 (11): 1392–401. doi:10.1038/nbt1259. PMID 17053790.
- ↑ 17. Verlinsky, Y; Strelchenko, N; Kukharenko, V; Rechitsky, S; Verlinsky, O; Galat, V; Kuliev, A (2005). "Human embryonic stem cell lines with genetic disorders". Reproductive Biomedicine Online. 10 (1): 105–10. doi:10.1016/S1472-6483(10)60810-3. PMID 15705304
- ↑ Tichy ED, Pillai R, Deng L, et al. (November 2010). "Mouse embryonic stem cells, but not somatic cells, predominantly use homologous recombination to repair double-strand DNA breaks". Stem Cells Dev. 19 (11): 1699–711. doi:10.1089/scd.2010.0058. PMC 3128311. PMID 20446816
- ↑ 19. Knoepfler, Paul S. (2009). "Deconstructing Stem Cell Tumorigenicity: A Roadmap to Safe Regenerative Medicine". Stem Cells. 27 (5): 1050–6. doi:10.1002/stem.37. PMC 2733374. PMID 19415771.
- ↑ Varlakhanova, Natalia V. ; Cotterman, Rebecca F. ; Devries, Wilhelmine N. ; Morgan, Judy; Donahue, Leah Rae; Murray, Stephen; Knowles, Barbara B. ; Knoepfler, Paul S. (2010). "Myc maintains embryonic stem cell pluripotency and self-renewal". Differentiation. 80 (1): 9–19. doi:10.1016/j.diff.2010.05.001. PMC 2916696. PMID 20537458.
- مشارکتکنندگان ویکیپدیا. «Embryonic stem cell». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۹ ژوئن ۲۰۱۷.