فشار بخار
فشار بخار (بخار اشباع) یا فشار بخار تعادل به عنوان فشار اعمال شده توسط بخار در تعادل ترمودینامیکی با فازهای تراکم آن (جامد یا مایع) در یک سیستم بسته تعریف میشود. فشار بخار تعادل نشانه ای از میزان تبخیر مایع است. این مربوط به گرایش ذرات برای فرار از مایع (یا جامد) است. ماده ای با فشار بخار بالا در طبیعی اغلب به عنوان فرار شناخته میشود. فشار ناشی از بخار موجود در بالای سطح مایع به عنوان فشار بخار شناخته میشود. با افزایش دمای مایع، انرژی جنبشی مولکولهای آن نیز افزایش مییابد و انتقال مولکولها به بخار نیز افزایش مییابد، در نتیجه فشار بخار افزایش مییابد.
اگر فشار بخار بیش از مقدار تعادل ترمودینامیکی باشد، تراکم در حضور سایتهای هسته ای رخ میدهد. این اصل بومی در اتاقهای ابر است، جایی که ذرات یونیزه هنگام عبور از آنها، آهنگهای تراکم را تشکیل میدهند.
فشار بخار هر ماده با توجه به رابطه Clapeyron-Clausius بهطور غیر خطی با درجه حرارت افزایش مییابد. نقطه جوش فشار اتمسفر مایع (نقطه جوش طبیعی) درجه حرارتی است که در آن فشار بخار برابر فشار اتمسفر محیط است. با افزایش در این درجه حرارت، فشار بخار برای غلبه بر فشار اتمسفر کافی است و مایع را به شکل حبابهای بخار داخل بخش عمده ماده درمیآورد. تشکیل حباب در اعماق مایع به دلیل افزایش فشار نیاز به دمای بالاتری دارد. کشش سطحی ناشی از دیواره حباب منجر به فشار بیش از حد در حبابهای بسیار کوچک و اولیه میشود. فشار بخاری که یک جزء در یک مخلوط به فشار کلی سیستم اضافه میکند، فشار جزئی نامیده میشود. به عنوان مثال، هوا در سطح دریا، و اشباع با بخار آب در دمای ۲۰ درجه سانتیگراد، فشار جزئی حدود ۳٫۲ کیلوپاسکال از آب، ۷۸ کیلوپاسکال از نیتروژن، ۲۱ کیلوپاسکال از اکسیژن و ۹٫۰ کیلوپاسکال از آرگون را دارد، که درکل 2.102 KPa بر پایه فشار استاندارد اتمسفر میباشد.
اندازهگیری و واحدها
ویرایشفشار بخار در واحدهای استاندارد فشار اندازهگیری میشود. سیستم بینالمللی واحدهای (SI) فشار را به عنوان یک واحد مشتق شده با واحد نیرو بر سطح تشخیص میدهد و پاسکال (PA) را به عنوان واحد استاندارد آن تعیین میکند. یک پاسکال یک نیوتن در هر متر مربع (N·m−۲ یا kg·m−۱·s−۲)است. اندازهگیری تجربی فشار بخار یک روش ساده برای فشار رایج بین ۱ تا ۲۰۰ کیلوپاسکال میباشد. دقیقترین نتایج، در نزدیکی نقطه جوش مواد و پرخطاترین نتایج به دست آمده برای اندازهگیریهای کوچکتر از 1 KPa است. مراحل اغلب شامل تمیز کردن مواد آزمایشی، ایزوله کردن در یک ظرف، تخلیه هر گاز خارجی، سپس اندازهگیری فشار تعادل فاز گاز از ماده در ظرف در دمای مختلف میباشد. زمانی نتیجه دقیق تر به دست میآید که تمام نکات رعایت شده و اطمینان حاصل شود که کل ماده و بخار آن در دمای تجویز شده قرار دارد. این کار مثلاً با استفاده از یک ایزوتنسیکوپ، با غوطه ور شدن محل نگهداری در یک حمام مایع انجام میشود. فشار بخارهای کم در جامدات را میتوان با استفاده از روش Knudsen effusion cell اندازهگیری کرد. در یک زمینه پزشکی، فشار بخار گاهی اوقات در واحدهای دیگر بیان میشود، بهطور خاص میلیمتر جیوه (MMHG) برای داروهای بی هوشی فرار بسیار مهم است که اکثر آنها مایعات با دمای بدن هستند، اما با فشار بخار نسبتاً بالا.
فشار بخار با معادله آنتوان
ویرایشمعادله آنتوان یک بیان ریاضی تجربی از رابطه بین فشار بخار و دمای مایع خالص یا مواد جامد است. از روی منحنی بدست میآید و با این واقعیت سازگار است که فشار بخار معمولاً در حال افزایش است و به صورت تابعی از دما است. شکل اصلی معادله:
(
میتوان نوشت
فرم سادهتر که میتوان استفاده کرد:
تصعید و تبخیر از همان ماده، همانند اجزای موجود در مخلوطها، دارای ضرایب آنتوان جداگانه هستند. هر پارامتر تنظیم شده برای یک ترکیب خاص فقط در محدوده دمایی مشخص قابل اجرا است. بهطور کلی، دامنههای دما برای حفظ دقت معادله تا حد ۸–۱۰ درصد انتخاب میشوند. برای بسیاری از مواد فرار، چندین مجموعه پارامتر مختلف موجود است و برای دامنههای مختلف دما استفاده میشود. معادله آنتوان در هنگام استفاده از نقطه ذوب یک ترکیب تا دمای بحرانی آن، از دقت کمی برخوردار است. به دلیل محدودیت دستگاهی که برای ایجاد مقادیر پارامترهای آنتوان استفاده میشود، هنگامی که فشار بخار زیر 10 Torr باشد، دقت نیز ضعیف است.
معادله واگنر یکی از بهترین موارد را برای دادههای تجربی ارائه میدهد اما کاملاً پیچیدهاست که فشار بخار را به عنوان تابعی از کاهش دما بیان میکند.
عوامل مؤثر بر فشار بخار مایع
ویرایشعوامل زیر در فشار بخار مایع خالص مؤثر است:
- دما: برای مایعی معین، هر چه دما بالاتر باشد، فشار بخار اکثر مایع بیشتر خواهد بود.
- ساختار مولکولی: برای چند مایع در دماهای یکسان، هر چه نیروهای جاذبهٔ بین مولکولی قویتر باشد، فشار بخار مایع کمتر خواهد بود.
در مورد محلولها، فشار بخار محلولی که حلشوندهٔ غیرفرّار دارد، از فشار بخار حلّال خالص کمتر است.
ارتباط با نقطه جوش مایع
ویرایشدر دمای معین، هر چه فشار بخار مایعی بیشتر باشد، نقطهٔ جوش آن پایینتر خواهد بود؛ زیرا یک مایع زمانی به جوش میآید که فشار بخار آن با فشار هوای محیط برابر شود، و همانطور که گفته شد، فشار بخار مایع با دمای جوشش رابطهٔ معکوس دارد؛ پس هر چه فشار بخار مایعی بیشتر باشد، در دمای پایینتری به جوش میآید.
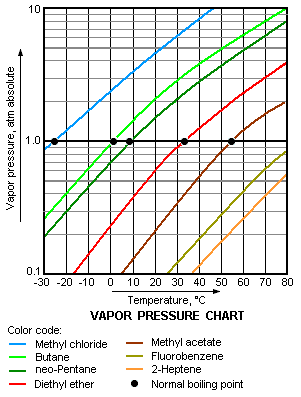
به عنوان یک روند کلی، فشار بخار مایعات در دمای محیط با کاهش نقطه جوش افزایش مییابد. این در نمودار فشار بخار نشان داده شدهاست (به سمت راست نگاه کنید) که نمودارهای فشار بخار را در مقایسه با دماهای مختلف برای انواع مایعات نشان میدهد. در نقطه جوش طبیعی مایع، فشار بخار برابر با فشار اتمسفر استاندارد به عنوان ۱ اتمسفر، 760Torr، 101.325 kPa یا 14.69595psi تعریف شده.
به عنوان مثال، در هر درجه حرارت داده شده، متیل کلرید دارای بالاترین فشار بخار هر یک از مایعات در نمودار است. همچنین دارای کمترین نقطه جوش طبیعی (۲۴٫۲- درجه سانتیگراد) است که جایی قرار دارد که منحنی فشار بخار متیل کلرید (خط آبی) خط فشار افقی یک اتمسفر (atm) فشار بخار مطلق را تجزیه میکند.
اگر چه ارتباط بین فشار بخار و درجه حرارت غیر خطی است، نمودار از یک محور عمودی لگاریتمی برای تولید خطوط کمی منحنی استفاده میکند، بنابراین یک نمودار میتواند گراف بسیاری از مایعات را دربرداشته باشد. در نمودار هنگامی که لگاریتم فشار بخار در برابر 1/(T+۲۳۰)قرار میگیرد، (T درجه حرارت در درجه سانتیگراد است) تقریباً یک خط مستقیم ایجاد میشود. فشار بخار مایع در نقطه جوش آن برابر فشار محیطی اطراف آن است.
ترکیب مایعات:قانون رائولت
ویرایشقانون رائولت تخمینی برای فشار بخار ترکیب مایعات ارائه میدهد و بیان میکند که فعالیت (فشار یا فوگاسیته) یک مخلوط تک فاز برابر با مجموع کسر مولی وزنی فشارهای بخار اجزاء است:
که Ptot نشان دهنده بخار ترکیب است،xi و yi به ترتیب نشان دهنده کسر مولی جز i در فاز مایع و کسر مولی جز i در فاز بخار میباشند.Pisat فشار بخار جز i است. قانون رائولت فقط برای غیر الکترولیتها (گونههای بدون بار) قابل استفاده است و برای مولکولهای غیر قطبی تنها با جاذبههای بین مولکولی ضعیف (مانند نیروهای لاندون) مناسب است.
گفته میشود که سیستمهایی که فشار بخار آنها بیشتر از فرمول فوق است، انحراف مثبت دارند. چنین انحرافی جاذبه بین مولکولی ضعیف تری را نسبت به اجزای خالص نشان میدهد، بنابراین میتوان تصور کرد که مولکولها در فاز مایع با شدت کمتری نسبت به مایع خالص «نگهداری میشوند». به عنوان مثال، میتوان به آزئوتروپ تقریباً ۹۵٪ اتانول و آب اشاره کرد. از آنجا که فشار بخار آزئوتروپ بالاتر از مقدار پیشبینی شده در قانون رائولت است، بنابراین در دمایی پایینتر از دمای هر یک از اجزای خالص میجوشد.
همچنین سیستمهایی با انحراف منفی وجود دارند که دارای فشار بخاری هستند که کمتر از حد انتظار است. چنین انحرافی گواهی بر جاذبه بین مولکولی قویتر بین اجزای ترکیب نسبت به اجزای خالص آن است؛ بنابراین، مولکولها با وجود مولکول دوم، در مایع قویتری «نگهداری میشوند». به عنوان مثال میتوان به مخلوط تری کلرومتان (کلروفرم) و ۲-پروپانون (استون) اشاره کرد که بالاتر از نقطه جوش هر یک از اجزای خالص میجوشند. از انحرافات منفی و مثبت میتوان برای تعیین ضرایب فعالیت ترمودینامیکی اجزای مخلوط استفاده کرد.
جامد
ویرایشفشار بخار تعادل را میتوان اینگونه تعریف کرد که فشار رسیده به فاز متراکم در تعادل با بخار خود باشد. در مورد یک جامد تعادل، مانند یک کریستال، این میتواند به عنوان فشار تعریف شود زمانی که سرعت تصعید یک ماده جامد با سرعت رسوب فاز بخار آن مطابقت داشته باشد. برای اکثر جامدات این فشار بسیار کم است، اما برخی از موارد استثنایی قابل توجه عبارتند از یخ خشک نفتالین (فشار بخار یخ خشک ۵٫۷۳ مگاپاسکال (831 psi، 56.5 atm) در ۲۰ درجه سانتیگراد، که باعث پارگی بیشتر ظروف مهر و موم شده میشود) و یخ، تمام مواد جامد دارای فشار بخار هستند. با این حال، به دلیل مقادیر اغلب بسیار کم آنها، اندازهگیری میتواند بسیار دشوار باشد. تکنیکهای معمول شامل استفاده از ترموگرافی و تعرق گاز است. تعدادی روش برای محاسبه فشار تصعید (به عنوان مثال، فشار بخار) یک ماده جامد وجود دارد. یک روش برای برآورد فشار تصعید از فشار بخار مایع برون یابی (مایع فوق سرد)، اگر گرمای همجوشی مشخص باشد، با استفاده از این شکل خاص از رابطه Clausius-Clapeyron میتوان بدست آورد.
فشار متعارف جز جامد در دمای
فشار بخار خارج شده از مولکول مایع در دما
H∆ گرمای همجوشی.
Rثابت گاز.
دمای تصعید است.
دمای نقطه ذوب است.
این روش فرض میکند که گرمای همجوشی مستقل از دما است، دمای انتقال اضافی بین فازهای مختلف جامد را نادیده میگیرد و برای دماهای نه چندان دور از نقطه ذوب تخمین میزند. همچنین نشان میدهد که فشار تصعید کمتر از فشار بخار مایع برون یابی است (AusH> 0) و اختلاف با افزایش فاصله از نقطه ذوب رشد میکند.
نقطه جوش آب
ویرایشمانند همه مایعات، آب هنگامی که فشار بخار آن به فشار اطراف خود میرسد میجوشد. در طبیعت، فشار جو در ارتفاعات پایینتر و آب در دمای پایین جوش میآید. دمای جوش آب برای فشارهای جوی را میتوان با معادله آنتوان تقریب زد:
یا تبدیل به این فرم صریح دما
دما نقطه جوش در درجه سانتیگراد است، و فشار P فشار در توراست.
قانون Duhring
ویرایشرابطه خطی بین دمای محلولهایی که تحت یک فشار بخار هستند برقرار است.
مثالها
ویرایش| دما (سانتیگراد) | فشار بخار(pa) | ماده |
|---|---|---|
| ۳۲۰۳ | ۱۰۰ | Tungsten |
| ۲۵ | ۶۰۰ | Xenon difluride |
| ۲۰ | ۲۳۰۰ | water |
| ۲۰ | ۲۴۰۰ | Propanol |
| ۲۵ | ۲۶۶۰ | Methyl
Isobutyl Ketone |
| ۲۰ | ۵۸۳۰ | Ethanol |
| ۲۰ | ۳۷۹۰۰ | Freon113 |
| ۲۰ | ۹۸۷۰۰ | Acetaldehyde |
| ۲۰ | ۲۲۰۰۰۰ | Butane |
| ۲۰ | ۴۳۵۷۰۰ | Formaldehyde |
| ۲۶٫۸۵ | ۹۹۷۸۰۰ | Propane |
| ۲۵ | 1.255 Mpa | Carbonyl sulfide |
| ۲۵ | 5.660 Mpa | Nitrous oxide |
| ۲۰ | 5.7 Mpa | Carbon dioxide |
تخمین فشار بخار از روی ساختار مولکولی
ویرایشبرای برآورد فشار بخار از ساختار مولکولی روشهای تجربی بسیاری وجود دارد تا فشار بخار را از ساختار مولکولی برای
مولکولهای آلی تخمین بزند.
فشار بخار در هواشناسی
ویرایشدر هواشناسی از اصطلاح فشار بخار به معنای فشار جزئی بخار آب در جو استفاده میشود، حتی اگر متعادل نباشد.
هواشناسان همچنین از اصطلاح فشار بخار اشباع برای تشخیص فشار بخار تعادل آب یا آب نمک بالای یک سطح صاف از فشار بخار تعادلی که شکل و اندازه قطرات آب و ذرات موجود در جو را در نظر میگیرد، استفاده میکنند.
جستارهای وابسته
ویرایشمنابع
ویرایش- مشارکتکنندگان ویکیپدیا. «Vapor pressure». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۲۹ می ۲۰۱۱.
- احمد روحالهی، سیفالله جلیلی، دوستمحمد سمیعی، نعمتالله ارشدی (۱۳۸۶)، شیمی (۳) و آزمایشگاه، تهران: شرکت چاپ و نشر کتابهای درسی ایران، ص. ص ۹۶، شابک ۹۶۴-۰۵-۱۳۵۵-۵