ماهیچه قلب
ماهیچه قلبی یا ماهیچه کاردیاک یا میوکاردیوم (به انگلیسی: Cardiac muscle) یکی از سه نوع ماهیچه مهرهداران است که دوتای دیگر، ماهیچه اسکلتی و ماهیچه صاف میباشند. این ماهیچه، غیرارادی و مخطط است که بافت اصلی دیوارههای قلبی را تشکیل میدهد. میوکاردیوم، تشکیل لایه میانی بین لایه بیرونی دیواره قلبی (اپیکاردیوم) و لایه داخلی (اندوکاردیوم) میدهد، همچنین خون از طریق گردش کرونری میوکاردیوم را تغذیه میکند. این نوع ماهیچه شامل سلولهای منفرد ماهیچه قلب (کاردیومیوسیتها) هستند که از طریق صفحات بینابینی به هم متصل شده و در فیبرهای کلاژن و دیگر مواد سازنده ماتریکس برونسلولی، دربرگرفته شدهاند.
| ماهیچه قلبی | |
|---|---|
 | |
 | |
| جزئیات | |
| بخشی از | میوکاردیوم قلب |
| شناسهها | |
| لاتین | Textus muscularis striatus cardiacus |
| MeSH | D009206 |
| TA98 | A12.1.06.001 |
| TA2 | 3950 |
| FMA | 9462 |
کششهای ماهیچه قلبی به طریق مشابه با ماهیچه اسکلتی صورت میپذیرد، گرچه که بین این دو تفاوتهای مهمی برقرار است. تحریک الکتریکی به شکل پتانسیل عمل، باعث آزادسازی کلسیم از منبع کلسیم داخل سلولی (از شبکه سارکوپلاسمی) میگردد. افزایش کلسیم موجب سر خوردن رشتههای ماهیچهای (میوفیلامنتها) در کنار یکدیگر، در فرایندی به نام تزویج تحریکی-انقباضی میگردد.
بیماریهای ماهیچه قلب از اهمیت زیادی برخوردار اند. این بیماریها شامل شرایطی میشوند که معلول محدودیت خون رسانی به ماهیچههاست، از جمله آنزین پکتوریس، سکته قلبی و دیگر بیماریهای ماهیچه قلبی که به آنها کاردیومیوپاتی میگویند.
منشأ انقباضات ماهیچهٔ قلب
ویرایشریتم طبیعی قلب از گره سینوسی یا گره پیشاهنگ (S.A.N)در دهلیز آغاز شده و پس از انتقال به گره دهلیزی-بطنی (A.V.N) در بطنها منتشر میشود. در نتیجه این نحو هدایت تحریک الکتریکی، ابتدا سلولهای عضلانی دهلیز و با فاصله کمی بطنها منقبض میشوند و همچنین ابتدا میوکارد دهلیزها شل شده و سپس بطنها شل میشوند.
تعداد ضربان قلب در حالت عادی بین ۶۰ تا ۱۰۰ ضربان در دقیقهاست که بر اساس ریتم گره سینوسی تنظیم میشود. در مواقع فعالیت با تحریک سیستم سمپاتیک و آزاد شدن نوراپینفرین ضربان قلب تندتر میشود.
خونرسانی
ویرایشسرخرگهای کرونری از آئورت بیرون میآیند این سرخرگها باعث خونرسانی به قسمت بیشتر عضله بطن چپ میشوند. بطن چپ دارای عضلات بیشتری نسبت به بطن راست میباشد زیرا وظیفه آن، تلمبه کردن خون به تمام قسمتهای بدن است. شریانهای کرونری راست، معمولاً کوچکتر بوده و قسمت زیرین قلب و بطن راست را خونرسانی میکند. وظیفه بطن راست تلمبه کردن خون به ریهها میباشد. شریانهای کرونری دارای ساختمانی مشابه تمام شریانهای بدن هستند اما فقط در یک چیز با آنها تفاوت دارند که فقط در زمان بین ضربانهای قلب که قلب در حالت استراحت (ریلکس) قرار دارد، خون در این شریانها جریان مییابد.
وقتی عضله قلب منقبض میشود، فشار آن به قدری زیاد میشود که اجازه عبور خون به عضله قلب را نمیدهد، به همین دلیل قلب دارای شبکه یِ مؤثری از رگهای باریک خونی است که تمام نیازهای غذایی و اکسیژنرسانی آن را به خوبی برآورده میکند. در بیماران سرخرگهای کرونری، سرخرگهای کرونری (سرخرگهای تاجی) تنگ و باریک میشوند و و عضلات قلب از رسیدن خون و اکسیژن به اندازه کافی محروم میگردند. در حالت استراحت، ممکن است مشکلی برای فرد ایجاد نشود، ولی هنگامیکه قلب ناچار باشد کار بیشتری انجام دهد و برای نمونه شخص بخواهد چند پله را بالا برود، سرخرگهای تاجی نمیتوانند بر پایه نیاز اکسیژن این عضلات، به آنها خون و اکسیژن برسانند و لذا شخص در هنگام بالا رفتن از پلهها دچار درد سینه (آنژین) میگردد. در چنین مواقعی اگر فرد کمی استراحت کند، درد از بین میرود. اگر یک سرخرگ تاجی به دلیل مسدود شدن آن با یک لخته خون، بهطور کامل مسدود شود، قسمتی از عضله قلب که دیگر خون به آن نمیرسد، خواهد مرد (سکته قلبی).
ساختار
ویرایشدرشت آناتومی
ویرایشبافت ماهیچه قلب یا میوکارد اکثر ساختار قلب را تشکیل می دهد. دیواره قلب از سه لایه تشکیل شده است: یک لایه ضخیم از میوکارد که بین اندوکارد داخلی و اپی کارد بیرونی قرار گرفته است. اندوکارد داخلی حفرههای قلب را میپوشاند، دریچههای قلب را میپوشاند و با اندوتلیومی که رگهای خونی متصل به قلب را میپوشاند ملاقات میکند. قسمت بیرونی میوکارد اپی کاردیوم است که بخشی از کیسه پریکارد را تشکیل می دهد که قلب را احاطه کرده، محافظت می کند و آن را روان می کند.[۱]
در داخل میوکارد، لایههایی از سلولهای عضلانی قلب یا کاردیومیوسیتها وجود دارد که به دور بطن چپ میپیچند. این لایهها در زوایای مختلف قرار گرفتهاند و امکان انقباض هماهنگ و فشردن خون کارآمد را در طول هر ضربان قلب فراهم میکنند. همانطور که صفحات منقبض می شوند، بطن در یک جهت کوتاه می شود، در جهت دیگر باریک می شود و می پیچد و خون را از قلب به حداکثر می رساند.[۲]
انقباض عضله قلب نیاز به جریان مداوم خون برای تامین اکسیژن و مواد مغذی دارد که توسط شریان های کرونر که خون را از ریشه آئورت به میوکارد می آورند تسهیل می شود. سپس وریدهای کرونر خون را به دهلیز راست تخلیه می کنند.[۱]
میکروآناتومی
ویرایشسلول های عضله قلب یا کاردیومیوسیت ها واحدهای انقباضی عضله قلب هستند. آنها توسط یک ماتریکس خارج سلولی که با حمایت از سلول های فیبروبلاست تولید می شود احاطه شده اند. کاردیومیوسیت های اصلاح شده تخصصی به نام سلول های ضربان ساز مسئول تنظیم ریتم انقباضات قلب هستند. این سلولهای ضربانساز بدون سارکومر ضعیف انقباض هستند و از طریق اتصالات شکاف به سلولهای انقباضی همسایه متصل میشوند. [۳]ضربان ساز اولیه، گره سینوسی دهلیزی، بر روی دیواره دهلیز راست در نزدیکی ورودی ورید اجوف فوقانی قرار دارد، در حالی که ضربان سازهای ثانویه در گره دهلیزی بطنی یافت می شوند.[۴]
سلول های ضربان ساز که در سراسر قلب قرار دارند، نقش مهمی در تنظیم ضربان قلب دارند. این سلول ها مسئول تولید و انتقال تکانه های الکتریکی و همچنین دریافت و پاسخ به سیگنال های مغز هستند. اندازه و رسانایی سلولهای ضربان ساز در نواحی مختلف قلب متفاوت است، سلولهای گره سینوسی دهلیزی و دهلیزی کوچکتر هستند و با سرعت کمتری هدایت میشوند، در حالی که سلولهای تخصصی در بسته فیبرهای هیس و پورکنژ از نظر قطر و هدایت بزرگتر هستند. با سرعت بیشتری سیگنال می دهد.[۵]
فیبرهای پورکنژ انتقال سریع سیگنال های الکتریکی در قلب را تسهیل می کنند، در حالی که شریان های کرونر و شبکه مویرگی مواد مغذی را تامین می کنند و مواد زائد را از سلول های عضلانی حذف می کنند.[۶] سلولهای عضله قلب که به عنوان کاردیومیوسیت شناخته میشوند، انقباضات خود را برای پمپاژ مؤثر خون از قلب هماهنگ میکنند و هرگونه اختلال در این هماهنگی میتواند منجر به پمپاژ مؤثر قلب نشود، مانند ریتمهای غیرطبیعی قلب مانند فیبریلاسیون بطنی.[۷]
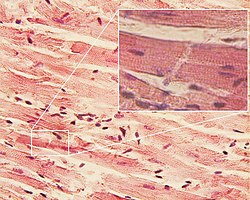
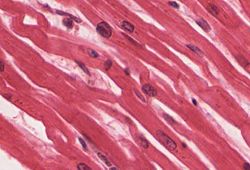
سلولهای عضلانی قلب با شکل مستطیلی خود مشخص میشوند که اندازه آنها بین 100-150μm در 30-40μm است، همانطور که از طریق میکروسکوپ مشاهده میشود.[۸] این سلولها توسط دیسکهای درهم به هم متصل شدهاند و فیبرهای بلندی را تشکیل میدهند و حاوی میوفیبریلهایی هستند که از پروتئینهای اکتین و میوزین تشکیل شدهاند که از کنار هم میلغزند. میوفیبریلها به سارکومرها، واحدهای انقباضی بنیادی سلولهای عضلانی، سازماندهی میشوند که به سلولهای ماهیچههای قلبی هنگام مشاهده از طریق میکروسکوپ، ظاهری راه راه یا مخطط میدهند.
کاردیومیوسیت ها، سلول های عضلانی قلب، دارای لوله های T، ساختارهای غشایی هستند که انقباض عضلانی را افزایش می دهند. این سلول ها به طور معمول دارای یک هسته هستند، اگرچه برخی ممکن است بر خلاف سلول های ماهیچه اسکلتی که دارای هسته های متعدد هستند، دارای دو هسته مرکزی باشند. علاوه بر این، کاردیومیوسیت ها حاوی میتوکندری های زیادی هستند که انرژی را به شکل ATP تامین می کنند و آنها را در برابر خستگی مقاوم می کند.
T-tubules
ویرایشT-tubules ساختارهای لولهای میکروسکوپی هستند که از سطح سلول به عمق داخلی سلول میروند. آنها به غشای سلولی متصل هستند و از همان دو لایه فسفولیپیدی مانند غشای سلولی تشکیل شده اند. لوله های T در عضله قلب بزرگتر و بیشتر از لوله های عضله اسکلتی هستند و در مرکز سلول به هم می پیوندند و یک شبکه عرضی محوری تشکیل می دهند. در داخل سلول، لوله های T در نزدیکی ذخیره کلسیم داخلی سلول قرار دارند که به شبکه سارکوپلاسمی معروف است، جایی که با بخشی از شبکه به نام سیسترنا انتهایی، که به عنوان دیاد شناخته می شود، جفت می شوند.[۹]
T-tubules نقش مهمی در انتقال تکانه های الکتریکی، که به عنوان پتانسیل عمل شناخته می شوند، از سطح سلول به هسته سلول ایفا می کنند. آنها همچنین از طریق فرآیندی به نام جفت شدن تحریک-انقباض به تنظیم غلظت کلسیم در سلول کمک می کنند. علاوه بر این، لولههای T در بازخورد مکانیکی-الکتریکی دخیل هستند، همانطور که توسط تبادل محتوای T-لولهای ناشی از انقباض سلولی مشهود است، که از طریق مشاهدات توموگرافی الکترونی کانفوکال و سه بعدی تأیید شد.[۱۰]
دیسک های درونی
ویرایشسینسیتیوم قلبی شبکه ای از قلب است که توسط دیسک های درونی متصل شده اند، که انتقال سریع سیگنال الکتریکی را در سراسر شبکه تسهیل می کند و انقباض هماهنگ میوکارد را ممکن می سازد. سنسیتیوم دهلیزی و بطنی وجود دارد که هر کدام توسط فیبرهای اتصال قلبی به هم متصل می شوند.[۱۱] مقاومت الکتریکی کم در دیسکهای درونپیچشده امکان حرکت آسان یون را فراهم میکند و به پتانسیلهای عمل اجازه میدهد به سرعت از سلولی به سلول دیگر حرکت کنند. علاوه بر این، هر سینسیتیوم به "قانون همه یا هیچ" پایبند است، به این معنی که یا تمام سلولهای درون سینسیتیوم منقبض میشوند یا هیچ کدام این کار را نمیکنند.[۱۲]
دیسک های بینابینی ساختارهای چسبنده تخصصی هستند که در عضله قلب یافت می شوند و کاردیومیوسیت های منفرد را به یک سینسیتیوم الکتروشیمیایی بزرگتر متصل می کنند. این ساختارها برای انتقال نیرو در طول انقباض عضلانی ضروری هستند و از سه نوع متمایز اتصال سلول به سلول تشکیل شدهاند: پیوندهای چسبنده فاسیا لنگر رشتهای اکتین، دسموزومهای لنگر رشته میانی، و اتصالات شکاف.[۱۳] این اتصالات با هم کار می کنند تا گسترش پتانسیل های عمل بین سلول های قلبی را تسهیل کنند که منجر به دپلاریزاسیون عضله قلب می شود. سه نوع اتصال یک ساختار منفرد و ترکیبی را تشکیل می دهند.[۱۴][۱۵]
در زیر میکروسکوپ نوری، دیسکهای درهم بهصورت خطوط تیره رنگی دیده میشوند که سلولهای ماهیچهای قلب مجاور را جدا میکنند و عمود بر رشتههای عضلانی میروند. میکروسکوپ الکترونی مسیر پیچیدهتری را برای دیسکهای میانپیچیده نشان میدهد، که هر دو قسمت طولی و عرضی در بخش طولی قابل مشاهده است. در بزرگنمایی کم، دیسک درهم به صورت یک ساختار پیچیده الکترونی بر روی خط Z مبهم ظاهر می شود، در حالی که در بزرگنمایی زیاد، مسیر دیسک درهم پیچیده تر می شود.
فیبروبلاست ها
ویرایشفیبروبلاست های قلبی که در عضله قلب یافت می شوند، نقش مهمی در حمایت از بافت قلب دارند. در حالی که آنها نمی توانند مانند کاردیومیوسیت ها منقبض شوند، اما مسئول حفظ ماتریکس خارج سلولی اطراف خود هستند. در صورت آسیب، مانند انفارکتوس میوکارد، فیبروبلاستها میتوانند فعال شده و به میوفیبروبلاست تبدیل شوند، که خواص فیبروبلاستها و سلولهای ماهیچه صاف را نشان میدهند. میوفیبروبلاست ها کلاژن ایجاد می کنند و منقبض می شوند تا ناحیه آسیب دیده را به هم نزدیک کنند و به روند ترمیم کمک کنند.[۱۶]
فیبروبلاست ها، اگرچه از نظر تعداد در مقایسه با کاردیومیوسیت ها کمتر هستند، اما می توانند از طریق جفت شدن الکتریکی با چندین کاردیومیوسیت تعامل داشته باشند و بر غشای سطحی سلول عضلانی تأثیر بگذارند. فیبروبلاست ها همچنین ممکن است عایق الکتریکی باشند و پتانسیل تبدیل شدن به انواع سلول های دیگر مانند کاردیومیوسیت ها و سلول های چربی را داشته باشند. این یافته ها در ابتدا در سال 1960 در شرایط آزمایشگاهی مشاهده شد و بعداً در بافت قلب بومی از طریق تکنیک های اپتوژنتیک تأیید شد.[۱۷]
ماتریکس خارج سلولی
ویرایشماتریکس خارج سلولی (ECM) اطراف کاردیومیوسیت ها و فیبروبلاست ها از پروتئین هایی مانند کلاژن و الاستین و پلی ساکاریدها (زنجیره های قند) به نام گلیکوزآمینوگلیکان ها تشکیل شده است. این مواد برای سلولهای ماهیچهای حمایت و قدرت میدهند، به ماهیچههای قلب خاصیت ارتجاعی میدهند و با اتصال مولکولهای آب، آب را حفظ میکنند. ECM در مجاورت سلول های ماهیچه ای به عنوان غشای پایه نامیده می شود که عمدتاً از کلاژن نوع IV و لامینین تشکیل شده است. کاردیومیوسیت ها از طریق گلیکوپروتئین های تخصصی به نام اینتگرین به غشای پایه متصل می شوند.[۱۸]
توسعه
ویرایشانسان ها با تعداد ثابتی از سلول های عضله قلب یا کاردیومیوسیت ها به دنیا می آیند که در طول رشد کودکی اندازه آنها افزایش می یابد. مطالعات نشان میدهد که تنها بخشی از این سلولها در طول عمر فرد جایگزین میشوند و به طور متوسط کمتر از 50 درصد جایگزین میشوند.[۱۹] رشد تک تک کاردیومیوسیت ها در پاسخ به شرایط مختلف مانند ورزش، بیماری قلبی یا آسیب رخ می دهد. یک کاردیومیوسیت بالغ سالم شکل استوانهای دارد و طول آن تقریباً 100 میکرومتر و قطر آن 10 تا 25 میکرومتر است. دو نوع هیپرتروفی وجود دارد که می تواند در کاردیومیوسیت ها رخ دهد: هیپرتروفی خارج از مرکز که منجر به اتساع بطن می شود و هیپرتروفی متحدالمرکز که منجر به ضخیم شدن دیواره قلب می شود.[۲۰]
فیزیولوژی
ویرایشفیزیولوژی عضله قلب از نظر عملکرد اصلی آن، یعنی انقباض، شباهت هایی با ماهیچه اسکلتی دارد. هر دو نوع عضله از طریق مکانیسم یکسانی انقباضات را آغاز می کنند، که به عنوان پتانسیل عمل شناخته می شود، که شامل جریان یون در سراسر غشای سلولی است. در عضله قلب، پتانسیل عمل با افزایش غلظت کلسیم در سیتوزول باعث انقباض می شود که منجر به انقباض عضلانی می شود.
چرخه قلبی
ویرایشچرخه قلبی به فرآیندی اطلاق می شود که در آن قلب انسان با یک ضربان قلب شروع می شود و تا ضربان بعدی ادامه می یابد. این چرخه از دو مرحله تشکیل شده است: دیاستول و سیستول. در دیاستول، عضله قلب شل می شود و دوباره با خون پر می شود، در حالی که در سیستول، قلب منقبض می شود و خون را به بدن پمپ می کند. پس از پمپاژ، قلب بلافاصله آرام می شود و منبسط می شود تا خون جدیدی را دریافت کند که از ریه ها و سایر سیستم ها باز می گردد، قبل از اینکه دوباره منقبض شود تا خون را به بدن پمپ کند. یک قلب که به درستی کار می کند باید به طور کامل منبسط شود تا بتواند به طور موثر خون را پمپاژ کند.
در مرحله استراحت ضربان قلب، یون های موجود در سلول های میوکارد به دلیل پتانسیل استراحت قطبی شده جدا می شوند. این خاصیت خودکار بودن یا دپلاریزاسیون خود به خودی به غشای سلولی میوکارد نسبت داده می شود که به یون های سدیم اجازه می دهد تا به آرامی وارد سلول شوند تا به آستانه دپلاریزاسیون برسند. هنگامی که یون های سدیم وارد سلول می شوند، یون های کلسیم به دنبال آن دپلاریزاسیون را بیشتر می کنند. به دنبال این، یونهای پتاسیم به آرامی خارج میشوند تا دوباره قطبی شوند و در نتیجه یک دوره نسوز طولانی مدت ایجاد میشود.[۲۱]
مکانیسم افزایش غلظت کلسیم در سیتوزول بین عضلات اسکلتی و قلبی متفاوت است. در عضله قلب، جریان به سمت داخل یونهای سدیم و کلسیم در طول پتانسیل عمل منجر به آزادسازی پایدار کلسیم از شبکه سارکوپلاسمی از طریق فرآیندی به نام آزادسازی کلسیم ناشی از کلسیم میشود. در مقابل، حداقل کلسیم در طول پتانسیل عمل به سلولهای ماهیچهای اسکلتی جریان مییابد و شبکه سارکوپلاسمی مستقیماً با غشای سطحی جفت میشود. این تفاوتها در مدیریت کلسیم به ویژگیهای انقباضی متمایز این نوع ماهیچهها مربوط میشود، ماهیچههای قلبی برای انقباض به کلسیم خارج سلولی نیاز دارند، در حالی که رشتههای عضلانی اسکلتی میتوانند بدون آن منقبض شوند.
در طول انقباض سلول عضله قلب، رشته های پروتئینی بلند درون سلول از طریق نظریه رشته لغزنده روی یکدیگر می لغزند. دو نوع رشته وجود دارد، رشته های ضخیم متشکل از پروتئین میوزین و رشته های نازک متشکل از پروتئین های اکتین، تروپونین و تروپومیوزین. اتصال یون های کلسیم به پروتئین تروپونین باعث ایجاد مکانیسم چرخه پل متقاطع می شود که باعث می شود رشته های ضخیم از طریق میوزین به رشته های نازک متصل شوند و در نتیجه سلول کوتاه شود. هنگامی که غلظت کلسیم در سلول کاهش می یابد، تروپونین و تروپومیوزین محل های اتصال اکتین را می پوشانند و باعث شل شدن سلول می شوند.
بازسازی
ویرایشمطالعهای که در سال 2009 منتشر شد، این باور را که قبلاً وجود داشت مبنی بر اینکه سلولهای ماهیچههای قلب قابل بازسازی نیستند، به چالش کشید. محققان موسسه کارولینسکا در استکهلم دریافتند که نمونههای عضله قلب از افراد متولد قبل از سال 1955 که بسیاری از آنها به دلیل کمبود عضله قلب دچار ناتوانیهای رشدی بودند، شواهدی از بازسازی سلولی را نشان داد. با استفاده از نمونههای DNA از تعداد زیادی قلب، این مطالعه تخمین زد که یک انسان 4 ساله تقریباً 20 درصد از سلولهای عضلانی قلب را در سال تولید میکند و حدود 69 درصد از سلولهای عضلانی قلبی یک فرد 50 ساله تولید میشود. بعد از تولد علاوه بر این، محققان دریافتند که بازسازی قلب میتواند از طریق تقسیم کاردیومیوسیتهای از قبل موجود در طول فرآیند طبیعی پیری رخ دهد.[۲۲]
در اوایل دهه 2000، محققان کشف سلولهای بنیادی قلبی درونزای بالغ را گزارش کردند، با چندین مطالعه ادعا شد که دودمان سلولهای بنیادی مختلف، از جمله سلولهای بنیادی مغز استخوان، میتوانند به کاردیومیوسیت تمایز پیدا کنند و به طور بالقوه نارسایی قلبی را درمان کنند. با این حال، تلاشهای بعدی برای تکرار این یافتهها ناموفق بود و چندین مورد از مطالعات اولیه به دلیل تقلب علمی پس گرفته شدند.[۲۳]
تفاوت دهلیزها و بطن ها
ویرایشبافت عضله قلب هر دو دهلیز و بطن قلب را تشکیل می دهد، با تفاوت های جزئی بین میوکارد در این اتاق ها. میوکارد در بطن ها ضخیم تر است تا انقباضات قوی را تسهیل کند، در حالی که در دهلیزها نازک تر است. علاوه بر این، تفاوت هایی در اندازه و ساختار میوسیت های منفرد بین اتاقک های قلبی وجود دارد، به طوری که کاردیومیوسیت های بطنی طولانی تر و گسترده تر هستند و شبکه T-tubule متراکم تری دارند. اگرچه مکانیسمهای اساسی جابجایی کلسیم بین کاردیومیوسیتهای بطنی و دهلیزی مشابه است، تفاوتهایی در اندازه و مدت زمان گذرای کلسیم وجود دارد که کوچکتر است و در میوسیتهای دهلیزی سریعتر تحلیل میرود و منجر به افزایش ظرفیت بافر کلسیم میشود. علاوه بر این، تفاوتهای مشخصی در مکمل کانالهای یونی بین محفظهها وجود دارد که منجر به طولانیتر شدن مدت زمان پتانسیل عمل و دورههای نسوز مؤثر در بطنها و همچنین حضور جریانهای یونی خاص که فقط در کاردیومیوسیتهای دهلیزی یافت میشود که می تواند برای درمان فیبریلاسیون دهلیزی هدف قرار گیرد.[۲۴]
اهمیت بالینی
ویرایشکاردیومیوپاتی ها که بیماری هایی هستند که عضله قلب را تحت تاثیر قرار می دهند، علت اصلی مرگ و میر در کشورهای توسعه یافته است. شایع ترین بیماری بیماری عروق کرونر است که زمانی رخ می دهد که خون رسانی به قلب به دلیل تشکیل پلاک های آترواسکلروتیک در عروق کرونر کاهش می یابد. این می تواند باعث درد قفسه سینه در حین ورزش شود که با استراحت تسکین می یابد و اگر شریان کرونر به شدت باریک یا مسدود شود، می تواند منجر به انفارکتوس میوکارد یا حمله قلبی شود. کاردیومیوپاتی هیپرتروفیک، کاردیومیوپاتی متسع و کاردیومیوپاتی محدود کننده انواع خاصی از کاردیومیوپاتی هستند که می توانند ناهنجاری هایی در عضله قلب ایجاد کنند و برخی از این بیماری ها به دلیل جهش های ژنتیکی ایجاد می شوند و می توانند ارثی باشند.
آسیب عضله قلب می تواند با وجود خون رسانی طبیعی رخ دهد و منجر به شرایطی مانند میوکاردیت شود که در اثر عفونت ویروسی یا سیستم ایمنی بدن ایجاد می شود. سایر علل آسیب عضله قلب شامل مواد مخدر، الکل، فشار خون بالا و تپش غیر طبیعی مداوم قلب است. اگر آسیب به اندازه کافی شدید باشد، می تواند عملکرد پمپاژ قلب را کاهش دهد و منجر به نارسایی قلبی شود. آسیب قابل توجه به سلول های عضله قلب به عنوان میوسیتولیز شناخته می شود که به عنوان نکروز سلولی انعقادی یا ارتباطی طبقه بندی می شود.[۲۵]
بیماریها
ویرایشمیوکارد در بیماریهای مختلفی مانند کاردیومیوپاتی، کاردیومگالی (بزرگ شدن ماهیچه قلب)، میوکاردیت (التهاب ماهیچه قلب) و بیماریهای ایسکمیک قلبی (کمبود اکسیژنرسانی به قلب) تحت تأثیر قرار میگیرد.
منابع
ویرایش- ↑ ۱٫۰ ۱٫۱ S., Sinnatamby, Chummy (2006). Last's anatomy : regional and applied. Last, R. J. (Raymond Jack) (11th ed.). Edinburgh: Elsevier/Churchill Livingstone. ISBN 978-0-443-10032-1
- ↑ Stöhr, Eric J.; Shave, Rob E.; Baggish, Aaron L.; Weiner, Rory B. (2016-09-01). "Left ventricular twist mechanics in the context of normal physiology and cardiovascular disease: a review of studies using speckle tracking echocardiography". American Journal of Physiology-Heart and Circulatory Physiology (به انگلیسی). 311 (3): H633–H644. doi:10.1152/ajpheart.00104.2016. ISSN 0363-6135.
- ↑ Zhenxing Pan; Shinji Doi (2010-11). "Variability of pacemaker rhythm in a detailed model of cardiac sinoatrial node cells". TENCON 2010 - 2010 IEEE Region 10 Conference. IEEE. doi:10.1109/tencon.2010.5686665.
{{cite journal}}: Check date values in:|date=(help) - ↑ Nicoletti, Domenico (2023-07-14). "Sinoatrial node (SA)". Radiopaedia.org. Radiopaedia.org.
- ↑ Standring, Susan (2016). Gray's anatomy : the anatomical basis of clinical practice (Forty-first ed.). [Philadelphia]. p. 139. ISBN 9780702052309
- ↑ (Pathologist), Stevens, Alan (1997). Human histology. Lowe, J. S. (James Steven), Stevens, Alan (Pathologist). (2nd ed.). London: Mosby. ISBN 978-0723424857
- ↑ he ESC textbook of cardiovascular medicine. Camm, A. John., Lüscher, Thomas F. (Thomas Felix), Serruys, P. W., European Society of Cardiology (2nd ed.). Oxford: Oxford University Press. 2009. ISBN 9780199566990
- ↑ M., Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (2nd ed.). Dordrecht: Kluwer Academic Publishers. ISBN 978-0792371588
- ↑ Hong, TingTing; Shaw, Robin M. (2017-01). "Cardiac T-Tubule Microanatomy and Function". Physiological Reviews (به انگلیسی). 97 (1): 227–252. doi:10.1152/physrev.00037.2015. ISSN 0031-9333.
{{cite journal}}: Check date values in:|date=(help) - ↑ Kohl, Peter; Greiner, Joachim; Rog-Zielinska, Eva A. (2022-09). "Electron microscopy of cardiac 3D nanodynamics: form, function, future". Nature Reviews Cardiology (به انگلیسی). 19 (9): 607–619. doi:10.1038/s41569-022-00677-x. ISSN 1759-5002.
{{cite journal}}: Check date values in:|date=(help) - ↑ Jahangir Moini; Professor of Allied Health Everest University Indialantic Florida Jahangir Moini (2011). Anatomy and Physiology for Health Professionals. Jones & Bartlett Publishers. pp. 213–. ISBN 978-1-4496-3414-8
- ↑ Khurana (2005). Textbook Of Medical Physiology. Elsevier India. p. 247. ISBN 978-81-8147-850-4
- ↑ Zhao, Guangze; Qiu, Ye; Zhang, Huifang M.; Yang, Decheng (2019-01). "Intercalated discs: cellular adhesion and signaling in heart health and diseases". Heart Failure Reviews (به انگلیسی). 24 (1): 115–132. doi:10.1007/s10741-018-9743-7. ISSN 1382-4147.
{{cite journal}}: Check date values in:|date=(help) - ↑ Franke, Werner W.; Borrmann, Carola M.; Grund, Christine; Pieperhoff, Sebastian (2006-02). "The area composita of adhering junctions connecting heart muscle cells of vertebrates. I. Molecular definition in intercalated disks of cardiomyocytes by immunoelectron microscopy of desmosomal proteins". European Journal of Cell Biology (به انگلیسی). 85 (2): 69–82. doi:10.1016/j.ejcb.2005.11.003.
{{cite journal}}: Check date values in:|date=(help) - ↑ Goossens, Steven; Janssens, Barbara; Bonné, Stefan; De Rycke, Riet; Braet, Filip; van Hengel, Jolanda; van Roy, Frans (2007-06-15). "A unique and specific interaction between αT-catenin and plakophilin-2 in the area composita, the mixed-type junctional structure of cardiac intercalated discs". Journal of Cell Science (به انگلیسی). 120 (12): 2126–2136. doi:10.1242/jcs.004713. ISSN 1477-9137.
- ↑ Ivey, Malina J.; Tallquist, Michelle D. (2016). "Defining the Cardiac Fibroblast". Circulation Journal (به انگلیسی). 80 (11): 2269–2276. doi:10.1253/circj.CJ-16-1003. ISSN 1346-9843.
- ↑ Goshima, K.; Tonomura, Y. (1969-08). "Synchronized beating of embryonic mouse myocardial cells mediated by FL cells in monolayer culture". Experimental Cell Research (به انگلیسی). 56 (2–3): 387–392. doi:10.1016/0014-4827(69)90029-9.
{{cite journal}}: Check date values in:|date=(help) - ↑ Horn, Margaux A.; Trafford, Andrew W. (2016-04). "Aging and the cardiac collagen matrix: Novel mediators of fibrotic remodelling". Journal of Molecular and Cellular Cardiology (به انگلیسی). 93: 175–185. doi:10.1016/j.yjmcc.2015.11.005.
{{cite journal}}: Check date values in:|date=(help) - ↑ Bergmann, Olaf; Bhardwaj, Ratan D.; Bernard, Samuel; Zdunek, Sofia; Barnabé-Heider, Fanie; Walsh, Stuart; Zupicich, Joel; Alkass, Kanar; Buchholz, Bruce A. (2009-04-03). "Evidence for Cardiomyocyte Renewal in Humans". Science (به انگلیسی). 324 (5923): 98–102. doi:10.1126/science.1164680. ISSN 0036-8075.
- ↑ Göktepe, Serdar; Abilez, Oscar John; Parker, Kevin Kit; Kuhl, Ellen (2010-08). "A multiscale model for eccentric and concentric cardiac growth through sarcomerogenesis". Journal of Theoretical Biology (به انگلیسی). 265 (3): 433–442. doi:10.1016/j.jtbi.2010.04.023.
{{cite journal}}: Check date values in:|date=(help) - ↑ «CELLS alive! Going Offline». cellsalive.com. دریافتشده در ۲۰۲۴-۰۶-۰۲.
- ↑ Senyo, Samuel E.; Steinhauser, Matthew L.; Pizzimenti, Christie L.; Yang, Vicky K.; Cai, Lei; Wang, Mei; Wu, Ting-Di; Guerquin-Kern, Jean-Luc; Lechene, Claude P. (2013-01-17). "Mammalian heart renewal by pre-existing cardiomyocytes". Nature (به انگلیسی). 493 (7432): 433–436. doi:10.1038/nature11682. ISSN 0028-0836.
- ↑ Orlic, Donald; Kajstura, Jan; Chimenti, Stefano; Jakoniuk, Igor; Anderson, Stacie M.; Li, Baosheng; Pickel, James; McKay, Ronald; Nadal-Ginard, Bernardo (2001-04-05). "Bone marrow cells regenerate infarcted myocardium". Nature (به انگلیسی). 410 (6829): 701–705. doi:10.1038/35070587. ISSN 0028-0836.
- ↑ Ravens, U.; Wettwer, E. (2011-03-01). "Ultra-rapid delayed rectifier channels: molecular basis and therapeutic implications". Cardiovascular Research (به انگلیسی). 89 (4): 776–785. doi:10.1093/cvr/cvq398. ISSN 0008-6363.
- ↑ Baroldi, Giorgio (2004). The Etiopathogenesis of Coronary Heart Disease: A Heretical Theory Based on Morphology, Second Edition. CRC Press. p. 88. ISBN 9781498712811
- مشارکتکنندگان ویکیپدیا. «Cardiac Muscle». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ژانویه ۲۰۲۱.