تصویربرداری پزشکی
تصویربرداری پزشکی (به انگلیسی: Medical imaging) تکنیک و فرایند مورد استفاده برای ساختن تصاویری از بدن انسان (یا بخشها و عملکردهای آن) برای اهداف کلینیکی (روشهای پزشکی که در جستجوی شناخت، درمان و بررسی بیماریها هستند) یا علوم پزشکی (شامل مطالعات آناتومیک و فیزیولوژیک) است. تصویربرداری پزشکی، تداخلی است از چند شاخهٔ علوم همانند فیزیک پزشکی، مهندسی پزشکی، زیستشناسی، و اپتیک.
| تصویربرداری پزشکی | |
|---|---|
| تشخیص پزشکی | |
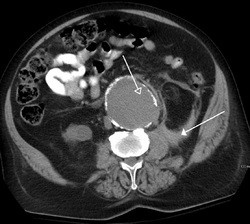 تصویر گرفته شده توسط سی تی اسکن که ضایعهای در آئورت را نشان میدهد. | |
| ICD-10-PCS | B |
| ICD-9 | 87-88 |
| سرعنوانهای موضوعی پزشکی | D003952 |
| OPS-301 code | 3 |
| مدلاین پلاس | ۰۰۷۴۵۱ |

تا سال ۲۰۱۰، ۵ میلیارد مطالعه تصویربرداری پزشکی در سراسر جهان انجام شدهاست.[۱] قرار گرفتن در معرض تشعشع از تصویربرداری پزشکی در سال ۲۰۰۶ حدود ۵۰ درصد از کل قرار گرفتن در معرض پرتوهای یونیزان در ایالات متحده را تشکیل میداد.[۲] تجهیزات تصویربرداری پزشکی با استفاده از فناوری صنعت نیمه هادی، از جمله تراشههای مدار مجتمع CMOS، دستگاههای نیمه هادی قدرت، حسگرهایی مانند حسگرهای تصویر (به ویژه سنسورهای CMOS) و حسگرهای زیستی، و پردازندههایی مانند میکروکنترلرها، ریزپردازندهها، پردازندههای سیگنال دیجیتال، پردازندههای رسانه و … تولید میشوند. دستگاههای سیستم روی تراشه تا سال ۲۰۱۵، محمولههای سالانه تراشههای تصویربرداری پزشکی بالغ بر ۴۶ میلیون واحد و ۱٫۱ میلیارد دلار بودهاست.[۳]
تعریف
ویرایشدر این مقاله و مقالات مربوط به آن، «پرتوشناسی» (رادیولوژی) زیرمجموعهای از علوم پزشکی تعریف گردیدهاست. در تصویربرداری پزشکی، روشهایی مانند میکروسکوپ نیروی اتمی یا میکروسکوپ الکترونی عبوری یا میکروسکوپ پرآب پویشی یا میکروسکوپ الکترونی روبشی که معمولاً کاربرد مستقیم بالینی ندارند در نظر گرفته نشدهاند، حال آنکه پرتوشناسی (یا رادیولوژی) بیشتر جنبه یک رشته آکادمیک دارد.
پیشینه
ویرایشاگرچه تاریخ مدونی دربارهٔ تصویربرداری پزشکی پرداخته نشدهاست، اما میتوان به نقش دانشمندان فیزیک و مهندسان در بستر تاریخی نیم نگاهی انداخت.
اولین تکنیک و مدالیته تصویربرداری مدرن با کشف اشعه ایکس توسط آقای ویلیام رونتگن در سال ۱۸۹۵ بازمیگردد. بیشتر تلاشهای فیزیکی برای پیشبرد سیستمهای رادیوگرافی و تصویربرداری با اشعه ایکس نظیر نمایشگرهای تشدیدکننده، مقطع نگاری، چرخاندن مجراهای آندی و … در ۱۰ تا ۲۰ سال پس از آن رخ داد.
اما نکته جالب در این زمینه این بود که، تغییرات و بهبودهای شگرف در تصویربرداری داخلی بیماریها بیشتر از جانب خلاقیت افراد آزمایشگاهی سرچشمه گرفت، تا دانشمندان فیزیک و مهندسان. برای تصویربرداری از نواحی مبهم انتخابی روشهای متنوعی توسعه پیدا کرد. از آن جمله میتوان به کاتادر، رنگدانههای عملگر دهانی و درون وریدی اشاره کرد. از اینرو وقتی رادیولوژیستها با محدودیتهای اجرایی دستگاهها مواجه میشدند، روشهای مختلفی که گاهی تهاجمی نیز بود، طراحی میکردند تا تصویربرداری ارگانهای ناپیدا را تسهیل کنند.
از اوایل دهه ۱۹۵۰ تا دهه ۱۹۷۰ انقلابی در سیستمهای تصویربرداری تشخیصی صورت گرفت. سیستمهای جدید برای تصویربرداری غیرتهاجمی آناتومیک و کارکردی (پروسه بیماری) توسعه یافت. در این بخش دانشمندان فیزیک و مهندسان نقش غالب را ایفا کردند. این انقلاب با تصویر برداری هستهای و التراسوند آغاز شد، که با وجود محدودیتهای جدی تصویرگری، به تصویر برداری پروسه بیماریها میپرداخت. که پیش از این و بدون این روشها امکانپذیر نبود. مقطع نگاری کامپیوتری حوزهٔ دیگری در تصویرگری پزشکی بود، که در اوایل دهه ۱۹۷۰ مطرح شد. توسط این تکنیک تصاویر مقطعی بسیار خوبی بدست آمد، که متناظر با اطلاعات حاصل از جراحیهای اکتشافی بود. دستگاهها به سرعت توسعه و بسط پیدا کردند و تکنیکهای استانداردی برای روشهای مختلف مطرح شد.
انقلابها و تحولات در شیوههای تصویربرداری ادامه پیدا کرد. این تحولات نه تنها به بهبود ژرف روی سیستمهای موجود منحصر شد، بلکه مطالعات پایهای و اولیهای برای شکلگیری مدالیتههای تصویر برداری جدید صورت گرفت. این روشهای جدید شامل استفاده از مایکرویو و پدیده رزونانس مغناطیسی هسته بودند.
بسیاری تولد رادیولوژی تشخیصی را به سال ۱۸۹۶ نسبت میدهند. در آن سال، نشریه لانست[۴] خبر از یک عمل جراحی داد که در آن برای نخستین بار از اشعه ایکس جهت یافتن تکه آهنی داخل استخوان کمر یک ملوان استفاده شده بود. ملوان با درآورده شدن تکه آهن از بدنش از حالت فلج خارج گردید. این روش (استفاده از پرتو ایکس برای دیدن داخل بدن) سپس سریعاً در اروپا و آمریکا رواج پیدا کرد.
دسته بندیها
ویرایشدستهبندیهای مختلفی برای تصویربرداری پزشکی ارائه شدهاست که در ادامه دستهبندی بر اساس منشأ تولید تصویر آورده میشود.
روشهای پرتوی یونیزهکننده
ویرایشپرتونگاری
ویرایشدو نوع از تصاویر حاصل از پرتونگاری در تصویربرداری پزشکی مورد استفاده قرار میگیرد؛ پرتونگاری تجسمی (به انگلیسی: Projection Radiography) و فلوروسکوپی (به انگلیسی: Fluoroscopy). با وجود مقطع نگاریهای سه بعدی (به انگلیسی: 3D Tomography) پیشرفته کنونی، این روشهای دوبعدی همچنان کاربرد گستردهای دارند؛ زیرا کم هزینه ترند، از رزولوشن بالایی برخوردار هستند و بسته به کاربرد از تشعشع کمتری برخوردارند. در این روش تصویرگری با استفاده از پرتو پرتو ایکس تصویر به وجود میآید. در حقیقت این روش پیشگام تصویرگری در پزشکی مدرن میباشد.
فلوروسکپی
ویرایشفلوروسکوپی را میتوان دریافت و کسب رشته تصاویر اشعه ایکس در یک بازه زمانی دانست، فلروسکوپی یک تکنیک عکس برداری X-ray است که به ما امکان میدهد به صورت همزمان با تصاویر ویدئویی تغییرات لحظهای بیمار را ثبت کنیم. در واقع تنها یک تصویر رادیوگرافی نخواهیم داشت بلکه چندین تصویر پشت سر هم در فاصله زمانی مورد نظر از مریض گرفته خواهد شد.
ضبط تصاویر بدست آمده برای بررسی بیشتر بعد از زمان تشعشع از جمله کارهایی است که در فلروسکوپی کارآمدی آن را در تشخیص بالا میبرد. به دلیل تشعشع یونیزهکننده متناوب به بیمار و همچنین حضور پزشک و رادیوگراف در محل تصویربرداری برای مشاهده آنی تغییرات، امنیت در آن از اهمیت بیشتری برخوردار خواهد بود و از شدت تشعشع کمتر نسبت به پرتونگاری استفاده میشود.
تصاویر زندهای از ساختارهای درون بدن به شیوه مشابه با پرتونگاری ایجاد میکند، با این تفاوت که از میزان پرتو اشعه X کمتری استفاده میکند همچنین به جای استفاده از فیلم برای ثبت تصویر از مادهٔ فلورسنت برای مشاهده پرتوها استفاده میشود چرا که بر خلاف سایر روشهایی که از اشعه X استفاده میکنند در این روش تصاویر به صورت realtime مشاهده میشوند. در واقع تنها یک تصویر رادیوگرافی نخواهیم داشت بلکه چندین تصویر پشت سر هم در فاصله زمانی مورد نظر از مریض گرفته خواهد شد.
ماموگرافی
ویرایشدر این روش نیز از اشعه X با دوز پایین استفاده میشود. مثل سایر روشهای تصویر برداری با اشعه X، دستگاه ماموگرافی، از تیوب اشعه X و آشکارساز (فیلمهای همراه با صفحات تشدیدکننده) و در بینشان از صفحه کنترل عوامل تابش، تشکیل شدهاست. در ضمن، از کمپرسور نیز برای فشرده کردن عضو، استفاده میشود، تا همه قسمتها با ضخامت مشابهی بوده و به اندازه کافی تابش ببینند تا از تمام بخشها تصویر گرفته شود.
مسئله مهمی که دربارهٔ لامپ تولیدکننده اشعه X وجود دارد، شکل خاص پستانها و از طرفی تفاوت ضخامت بافت میباشد، بهطوریکه قسمت نوک پستان هم نازکتر است و هر چه به قفسه سینه نزدک تر شویم، بافت ضخیمتر میباشد. در نتیجه شدت اشعه X تولیدی توسط لامپ در قسمت ضخیم باید بیشتر باشد تا در نهایت به صورت یکنواختی این عضو بدن را جاروب کرده باشد. همچنین در لامپهای پرتو X دستگاه ماموگرافی،انتخاب صافی مناسب، به منظور حذف پرتوهای کم انرژی بی فایده، و کاهش دوز جذبی اشعه X، نکتهای حائز اهمیت میباشد.
آنژیوگرافی
ویرایشآنژیوگرافی در اصطلاح به رادیوگرافی از عروق با استفاده از ماده حاجب اطلاق میشود، ولی در عمل گستره وسیع تری دارد. امروزه سالیانه بیشتر از ۶۲ میلیون نفر از این روش در آمریکا، استفاده میکنند.
در این تکنیک ماده حاجب مناسبی به داخل شریان یا ورید تزریق میشود، تا کنتراست کافی برای تصویربرداری به وجود آید. تزریق ماده حاجب توسط وسایل و تکنیکهای خاصی صورت میگیرد. ماده حاجب اغلب از طریق کتادر یا سوند مناسب، به این طریق وارد میشود که سوند داخل ورید یا شریان شده و تا ناحیه مورد بررسی پیش میرود و سپس تزریق انجام میشود.
تزریقهای دستی بیش از اندازه کند است و حجم ماده حاجب وارده کم میباشد. با بهبود وسایل آنژیوگرافی و لزوم وارد کردن حجم زیادی از ماده حاجب در مدت زمان کوتاه، تزریقکنندههای اتوماتیک ابداع شدند. این دستگاهها قادر به تنظیم و کنترل فاکتورهایی نظیر میزان فلو، حجم تزریق، زمان تأخیر و فشار تزریق میباشد. قابلیتهای زیاد و چشمگیری که در این نوع تزریقکنندهها وجود دارد، بسیاری از مسائل آنژیوگرافی نظیر بهکارگیری فشار بیش از اندازه یا خیلی سریع ماده حاجب، تزریق ناهماهنگ ماده کنتراست با ضربان قلب و تزریق اتفاقی هوا به بیمار را حل نمودهاست. تزریقکنندهها شامل دستگاه الکتروکاردیوگراف نیز میباشند تا به پزشک اجازه دهد، ماده حاجب هماهنگ با ضربان قلب تزریق شود.
انژکتور وسیله ایست که توانایی تزریق حاجب را بهطور اتوماتیک، دارد. در این دستگاه سرنگ تزریق، بر روی شفت یک موتور الکتریکی قرار گرفتهاست. همچنین مداری برای کنترل دارد، که سرعت تزریق دارو و سرعت تزریق (نرخ تزریق) را مشخص میکند. در ابتدا شریانی که مد نظر است، توسط کاتتر انتخاب شده و کاتتر توسط واسط، به انژکتور متصل میشود. از طرفی دارو به داخل سرنگ انژکتور کشیده شده، کافیست کلید شروع فشار داده شود.
امروزه آنژیوگرافرها علاوه بر موارد تشخیصی، به انجام آنژیوگرافی برای مقاصد درمانی نیز مبادرت میکنند. رادیولوژیستها میتوانند به وسیله سوند زدن فلورسکوپیک به تزریق داروهایی جهت قطع خونریزی بپردازند. کاربردهای دیگر آنژیوگرافی عبارت از تزریق داروهای شیمی درمانی به مناطق نئوپلازی، قرار دادن سوزنها و وسایل خاص در اندامها جهت نمونه برداری، و قرار دادن فیلتر در بزرگ سیاهرگ زیرین برای جلوگیری از انعقاد خون میباشد.
مقطع نگاری کامپیوتری (CT)
ویرایشاین روش تلفیق استفاده از توموگرافی معمولی (مقطع نگاری) با پردازشهای کامپیوتری میباشد. در این روش نیز از اشعه X استفاده میشود. البته دوز مورد استفاده در این روش بسیار بالاست و تفاوتهای ساختاری ای مثل استفاده از حرکت لامپ تولیدکننده اشعه X یا حرکت آشکارساز، همچنین گاهی آشکارسازهای حلقوی دور بیمار و …، با رادیو گرافی معمولی، دارد.
ولی تصاویری از سطح مقطعهای مختلف، در عمق دلخواه از اعضای بدن را، میدهد. در رادیوگرافی معمولی اطلاعات مربوط به عمق از دست میرفت. از طرفی نمیتوانست بین نسوج نرم تمایز ایجاد کند. طبعاً اطلاعات کمی مربوط به چگالی بافتها را نیز، در اختیارمان نمیگذاشت. در مقطع نگاری معمولی مشکل اول، یعنی تصویربرداری از یک مقطع دلخواه حل شد، ولی مقطع نگاری کامپیوتری دو مشکل دیگر رادیوگرافی معمولی را نیز حل کرد؛ یعنی حساسیت مورد نیاز برای تمایز بین نسوج نرم را دارا میباشد، همچنین اطلاعات کمی دربارهٔ میزان تضعیف (ناشی از عبور اشعه از نسوج) را نیز میدهد. البته در این روش قدرت تفکیک بهبود نیافته و تنها بخشهای ناخواسته، تارتر میشوند.
در حال حاضر سالیانه بیشتر از ۶۲ میلیون از این روش در آمریکا، استفاده میکنند و بر اساس تخمین یکی از نشریههای معتبر آمریکایی ۲٪ سرطانها (نوع بدخیم) ناشی از دوز بالای استفاده شده در این روش است. تلفیق دو روش PET و CT که تحت عنوان PET/CT شناخته شدهاست، روش جدیدی ست که در آن اطلاعات مربوط به آناتومی (حاصل از CT) با اطلاعات متابولیکی که مربوط به عملکرد و اجزا میباشند (آنچه که PETدر اختیارمان میگذارد) تلفیق شده و روشی مطلوب بهخصوص در مطالعه تومورها میباشد. نکته حائز اهمیت، عدم ضرورت استفاده از دوز بالای CT در این روش است. این روش ۸۵٪ در مطالعه تومورها (تشخیص سلولهای بدخیم از خوشخیم، مشاهده دقیق روند پیشروی سلولهای سرطانی و بررسی پاسخ به درمان و رادیوتراپی)، ۱۰٪ در نورولوژی ،۵٪ در مطالعات قلب، استفاده میشود.
روشهای پرتوی غیر یونیزهکننده
ویرایشدر این روش بر خلاف تصویربرداری با اشعه X و تصویربرداری هستهای، از پرتوهای پر انرژی استفاده نمیشود.
ام آر آی
ویرایشبا استفاده از پویشگر ام.آر. آی امکان عکس گرفتن از تقریباً همه بافتهای بدن وجود دارد. بافتی که کمترین اتمهای هیدروژن را دارد (مثل استخوانها) در تصویر تیره میشود، در حالی که بافتهای دارای اتمهای هیدروژن زیاد (مانند بافت چربی) روشنتر دیده میشوند. با تغییر زمان پالسهای امواج رادیویی امکان کسب اطلاعاتی دربارهٔ بافتهای مختلف موجود وجود دارد.
همچنین یک اسکن ام.آر. آی قادر است تصاویر واضحی را از بخشهایی از بدن که به وسیله بافت استخوانی احاطه شدهاند فراهم سازد بنابراین تکنیک فوق برای بررسی مغز و طناب نخاعی نیز مفید است. به دلیل آن که اسکن ام.آر. آی تصاویر بسیار مشروح و مفصلی را ارائه میدهد، بهترین تکنیک برای یافتن تومورها (اعم از خوشخیم و بدخیم) در مغز میباشد. در صورت وجود تومور از اسکن برای تشخیص گسترش احتمالی آن به بافتهای اطراف مغز استفاده میشود.
این تکنیک به ما امکان میدهد جزئیات دیگر در مغز را نیز بررسی کنیم. برای مثال مشاهده رشتههای بافت غیرنرمال که در صورت ابتلا بهام. اس روی میدهد را ممکن میسازد و نیز تغییرات رخ داده در هنگام خونریزی مغزی را نشان میدهد. همچنین تشخیص این که آیا بافت مغز پس از سکته مغزی دچار کمبود اکسیژن شدهاست را میسر میسازد. اسکن ام.آر. آی قادر به نشان دادن قلب و عروق خونی بزرگ در بافت اطراف آن است لذا تشخیص نواقص مادرزادی قلب و تغییرات در ضخامت عضلات اطراف آن پس از یک حمله قلبی را ممکن میسازد. تفاوت ام.آر. آی و سی تی اسکن در این است که با ام.آر. آی تصویربرداری از تقریباً هر زاویهای امکان دارد، در حالی که سی تی بهطور افقی عکس میگیرد. هیچ اشعه یونیزان (اشعه ایکس) در ایجاد تصویر ام.آر. آی دخالت ندارد. اسکنهای ام.آر. آی بهطور کلی مفصل تر و مشروح تر هستند. تفاوت بین بافت نرمال و غیرنرمال در اسکن ام.آر. آی نسبت به سی تی اسکن واضح تر است.
تاکنون هیچ خطر یا اثرات جانبی برای تکنیک ام.آر. آی شناخته نشدهاست. این آزمایش دردناک نیست و اصلاً احساس نمیشود. از آنجا که در آن از اشعه استفاده نمیشود بدون مشکل قابل تکرار است. تنها مورد ذکر شده صدمه احتمالی برای جنین در ۱۲ هفته اول بارداری مادر است لذا در این مدت ام.آر. آی برای زنان باردار انجام نمیشود. همچنین کارکنان باردار نیز باید در هنگام انجام عمل اسکن، یعنی وقتی که میدانهای الکترومغناطیسی متغیر با زمان ایجاد میشوند (لحظه روشن شدن کویلها) اتاق اسکن را ترک کنند. تنها ناراحتی بیمار از این است که در یک محفظه سیلندری شکل قرار میگیرد و برای افرادی که دچار تنگناترسی (هراس از جاهای بسته و تنگ) هستند چندان خوشایند نیست. همچنین دستگاهام. آر. آی معمولاً صداهای نسبتاً بلند و ناراحتکنندهای را ایجاد میکند. در ضمن از آنجا که بدن در میدان مغناطیسی قوی قرار میگیرد، لازم است از همراه داشتن هرگونه جواهرات، شیئ فلزی، پوشیدن لباسهایی با تکمههای فلزی اجتناب شود بنابراین در صورتی که هرگونه شیء فلزی مانند بستهای جراحی، سمعک و غیره همراه بیمار است باید مسوول دستگاه را از آن آگاه سازد.
در تصویر برداری با این روش، اتمهایی مورد نیاز هستند که هم از نظر مغناطیسی فعال باشند (یعنی دارای ویژگیهای اسپینی و ممان مغناطیسی بزرگ باشند تا بتوانیم هستهشان را مثل یک آهنربای کوچک با قطب N و S در نظر بگیریم) و هم به مقدار لازم در اعضای بدن موجود باشد. هسته اتم هیدروژن علاوه بر اینکه از نظر مغناطیسی فعال میباشد، در مولکولهای چربی و نیز در مولکولهای آب (که ۳/۲ وزن بدن را تشکیل میدهد) موجودست. دستگاه MRI از ۳ نوع مغناطیسکننده ساخته شدهاست. مغناطیسکننده دائم (که یکنواخت و ثابت است)، میدان مغناطیسی قوی ای ایجاد کرده و هستههای هیدروژن را همسو میکند. هرچقدر این میدان قوی تر باشد، تصاویر نهایی SNR بالاتری خواهند داشت. البته به تبع قوی بودن آن، احتمال آسیب به بدن انسان نیز بالاتر میرود. فرکانس تشدید مربوط به هیدروژن در محدوده RF از طیف مغناطیسی، واقع شدهاست. در نتیجه سیستم فرستنده و گیرنده امواج RF (رادیویی) در بدنه لولهای شکل دستگاه MRI قرار گرفتهاست (البته میتوان برای افزایش کیفیت تصاویر از کویلهای سطحی که دور تا دور ناحیه مورد تصویر برداری از بدن را میپوشانند، استفاده کرد. به بیان علمی تر اکنون میدان مغناطیسی متغیر بازمانی (که فرکانس تغییراتش RF میباشد) توسط کویل عمود بر میدان یکنواخت ثابت اولیه، به هستههای یکسو شده هیدروژن اعمال میشود. این اتمها از راستای اولیه منحرف شده (به بیان دیگر با گرفتن انرژی از امواج رادیویی برانگیخته میشوند و به حالت انرژی بالاتری میروند) با قطع موقت میدان ثانویه، این آهنرباهای کوچک (هستههای هیدروژن) به حالت اولیهشان بازمیگردند. در لحظه بازگشت، امواجی با فرکانس رادیویی یعنی RF تشعشع میکنند که توسط همان کویلها، دریافت میشوند. امواج دریافت شده به جریان الکتریسیته تبدیل و به رایانه داده میشوند و رایانه با استفاده از عملیات پردازشی و تبدیل فوریه و … تصویر تهیه میکند. روی هم رفته از سه میدان الکترومغناطیسی استفاده میشود: میدان مغناطیسی بسیار قوی و ایستا که میدان استاتیک نام دارد، میدان مغناطیسی ضعیف تر متغیر با زمان (در مجموع ۱ کیلو هرتز) برای کدگذاری فضایی، که میدان گرادیان نام دارد و میدان مغناطیسی ضعیف با فرکانس رادیویی (RF) برای دستکاری در هسته هیدروژن برای تولید سیگنالهای قابل اندازهگیری، که کویلهای RF نام دارد.
روش fMRI
ویرایشتصویرسازی تشدید مغناطیسی کارکردی (fMRI) یک نوع روش اندازهگیری فعالیت مغزی توسط شناسایی تغییرات مربوط به جریان خون است. انواع ابتدایی fMRI از کنتراست وابسته به سطح اکسیژن خون (BOLD) که توسط Ogawa شناسایی و معرفی شد، استفاده میکرد. این نوع تصویربرداری نوعی اسکن تخصصی از مغز و بدن است که برای نگاشت فعالیتهای عصبی مغز و نخاع انسانها و حیوانات از طریق تصویربرداری از تغییرات جریان خون (پاسخ همودینامیک) که وابسته به مصرف انرژی توسط سلولهای مغزی است، صورت میگیرد. از اوایل دهه ۱۹۹۰، این روش تصویربرداری کارکردی به روش متعارفی برای تحقیقات علمی شناخته شد، زیرا برای انجام آن نیازی نبود که افراد تحت عمل جراحی قرار گیرند، یا به مادهای تزریق شود یا تحت تأثیر تابش اشعهها قرار بگیرند.'
روشهای نوری
ویرایشواژه نور در علوم مهندسی معمولاً برای طیف مرئی، مادون قرمز و فرابنفش استفاده میشود. به دلیل اینکه نور جزو امواج الکترومغناطیسی است، در تصویر برداری رفتاری مشابه با سایر امواج الکترومغناطیسی (مثل X-Ray , MicroWave,...) از خود نشان میدهد. گسیلکنندههای طیف نزدیک مادون قرمز و همچنین لیزر از پرکاربردترین منابع در این روش تصویربرداری هستند.
تئوری کلی تصویربرداری نوری مبتنی بر جذب فوتونهای نوری توسط عناصر موجود در بدن انسان است، که این خود تولید رزولوشن میکند. از جذبکنندههای نوری مهم در بدن انسان، میتوان به هموگلوبین اکسیژن دار(Oxyhemoglobin) و هموگلوبین بدون اکسیژن(Deoxygenated hemoglobin) اشاره کرد. در بدن هرجا که خون وجود داشته باشد، این دو نیز وجود دارند. در هر عضو بدن انسان، نسبت غلظت هموگلوبین اکسیژن دار و هموگلوبین بدون اکسیژن نشان دهنده میزان متابولیسم است چون در در واکنشهای متابولیسمی اکسیژن مهمترین نقش را ایفا میکند.[۵]
میزان جذب نور در هموگلوبین اکسیژن دار و هموگلوبین بدون اکسیژن متفاوت است که این اساس تصویربرداری عملکردی مبتنی بر طیف نوری است. بیشترین جذب نور برای هموگلوبین اکسیژن دار در طول موج ۷۵۰ نانومتر و برای هموگلوبین بدون اکسیژن در طول موج ۸۵۰ نانومتری رخ میدهد.[۶]
طبق نمودار طیف الکترومغناطیسی این دو طول موج در محدوده طیف نزدیک مادون قرمز است که تصویربرداری عملکردی با طیفسنجی نزدیک مادون قرمز (Functional Nearinfrared Spectroscopy) نامیده میشود.
روش OCT
ویرایشمقطع نگاری همدوسی نوری (Optical Coherence Tomography) یا OCT نوعی روش مقطع نگاری در پزشکی است که تصاویری سه بعدی با رزولوشن در حد میکرومتر از واسط پراکندهکننده نور (به عنوان مثال بافت بیولوژیکی) بدست میآورد و اصول کار آن بر اساس تداخل سنجی نوری استوار میباشد. تصویر برداری با این روش مشابه با روش تصویر برداری اولتراسوند B مود میباشد که به جای امواج صوتی از نور استفاده میشود.
اولتراسوند
ویرایشروشی است که از خواص بافتها در واکنش با امواج فراصوتی تصویر میدهد. در این روش صوت با سرعت زیاد از یک مبدّل به درون بدن فرستاده میشود و تفاوت مقاومت صوتی بافتهای مختلف (از جمله بافتهای بیمار در مقایسه با بافتهای طبیعی) اساس آن را تشکیل میدهد.
سونوگرافی (اولتراسونو یا ماوراصوت) برای تشخیص کیستها، ساختمانهای پر از مایع (مثل مثانه و دستگاه صفراوی) و نشان دادن جنین در کیسه آمنیونی مناسب است. افزون بر این از سونوگرافی برای نشان دادن ساختمانهای توپری که دارای مقاومت صوتی متفاوت از بافتهای طبیعی اطراف هستند (مثل متاستازها) استفاده میشود. در عوض چون هوا، استخوان و تمام موارد کلسیفیه امواج ماورای صوت را جذب میکنند، در نتیجه این امواج نقش کمی در تشخیص بیماریهای ریوی یا استخوانی دارند.[۷]
نوعی از سونوگرافی موسوم به سونوگرافی داپلر، برای تصویربرداری خون جاری در قلب و عروق استفاده میشود. در مامایی نیز از سونوگرافی داپلر جهت گوش دادن به صدای قلب جنین استفاده میشود. سونوگرافی داپلر همچنین برای تشخیص ترومبوز وریدی به ویژه در اندامهای تحتانی، تنگی و انسداد شریانی به ویژه در شریان کاروتید استفاده میشود.
روشهای هستهای
ویرایشاسپکت
ویرایشمقطع نگاری کامپوتری تشعشع تک فوتونی در سال ۱۹۷۷ معرفی شد. کیفیت تصاویر این روش نسبت به روش تصویرگری هستهای معمولی به وسیلهٔ دوربین ثابت، بسیار بهتر است. اسکن اسپکت یا اسکن توموگرافی با انتشار فوتون، یک آزمایش تصویربرداری است که نشان میدهد جریان خون در بافتها و اندامها چگونه است. این ممکن است برای کمک به تشخیص تشنج، سکته مغزی، شکستگی ضربه ای، عفونت و تومورهای ستون فقرات باشد. این روش مشابه تصویربرداری CT میباشد (به بیان دیگر مقطع نگاری در پزشکی هستهای میباشد) با این تفاوت که از تابش اشعههای گاما استفاده میشود. پرتودارو (یا همان tracer) از طریق تزریق یا تنفس یا … وارد جریان خون میشود. پرتودارو متشکل از دو بخش میباشد: دارویی که با ایزوتوپ رادیواکتیو برچسبگذاری شدهاست. ایزوتوپ رادیو اکتیو در بدن متلاشی شده منجر به تولید اشعههای گاما میشود. برخلاف تصویربرداری معمولی صفحهای که در پزشکی هستهای استفاده میشود، این روش تصاویر ۳ بعدی میدهد. کاربرد عمدهٔ این روش (که تصاویر ۳ بعدی از فعالیتهای متابولیکی داخل بدن، میدهد)، تصویربرداری از تومور، استخوانهای بدن، تیروئید و همچنین مطالعات مربوط به رشد و سرایت بیماری، میباشد.
پت اسکن
ویرایشمقطع نگاری به کمک تشعشع پوزیترون است. در این روش سیستم از تعداد زیادی آشکارساز جرقهای، که بیمار را احاطه کردهاند، ساخته شدهاست. از طرفی میدانیم که به دنبال نابودی یک پوزیترون و یک الکترون، دو فوتون با انرژی ۵۱۱ کیلو الکترون ولت، در دو راستای مخالف، صادر میشوند. در روش مقطع نگاری به کمک تشعشع پوزیترون، اطلاعات نقش شده لازم برای بازسازی تصویر، بر اساس کشف همزمان دو فوتون مذکور، روی آشکارساز، بدست میآیند.
مزیت عمده این روش تصویربرداری، گرفتن تصویر از عملکرد(function) و فیزیولوژی میباشد. در این روش ابتدا ماده پرتودارو، به وسیلهٔ تزریق یا تنفس وارد بدن میشود. بعد از مدت زمان کمی که بر حسب نوع پرتو داروی استفاده شده، متفاوت میباشد، پرتوداروی استفاده شده، در عضو هدف تجمع پیدا میکند (نوع پرتو دارو را بر این اساس انتخاب میکنیم که، عملکرد کدام عضو، مدنظر ماست) پرتودارو، شامل رادیونوکلوئید (تابشکننده پوزیترون) است که به وسیلهٔ یک حامل وارد بدن میشود. بعد از تجمع رادیو ایزوتوپ در ناحیه هدف، رادیو ایزوتوپ تجزیه شده و ذرات پوزیترون تابش میکند. پوزیترونها با الکترون ترکیب شده، پدیده نابودی، رخ میدهد. در این رخداد، دو فوتون گاما با زاویه ۱۸۰ درجه، تابش میشوند. هر فوتون ۵۱۱ کیلوالکترون ولت انرژی دارد. در صورتی که در دو آشکارساز مقابل هم، دو فوتون به صورت همزمان یا اختلاف زمانی در حد چند نانوثانیه، ثبت شوند، به اصطلاح رایج، یک «رخداد صحیح» به وجود آمدهاست. این دو ثبت که در مقابل هم واقع شدهاند، تشکیل یک خط میدهند (line of response). مجموعه این رخدادها، در آشکارساز، توزیع پرتودارو را نشان میدهند. در نتیجه ناحیه دقیق تجمع و مصرف پرتو دارو، اطلاعات فیزیولوژیکی از عضو مورد نظر را میدهد. برای نمونه اگر هدف مطالعه مغز باشد، از پرتوداروی حاوی گلوکز (که در فعالیتهای مغزی مصرف میشود) استفاده میکنند و توسط تصویر گرفته شده، ناحیههای فعال در مغز، در طی فعالیتی خاص مثل گوش دادن به موسیقی مورد مطالعه، مشخص میشوند.
دیگر روشهای پزشکی هستهای
ویرایش- اسکن استخوان: تزریق موادی پرتوزا، تجمع آن در مغز استخوان، و تصویربرداری و تشخیص آن توسط یکی از روشهای تصویربرداری (تصویر زیر را ببینید). تومورها را لذا میتوان با جذب نسبی بیشتر ماده رادیواکتیو مشاهده کرد و تمیز داد.
- اسکن مغزی: تزریق موادی پرتوزا، عبور آن از سد خونی مغز، تجمع آن در آسیبدیدگیهای مغزی (مثل تومورها)، و تصویربرداری و تشخیص آن توسط یکی از روشهای تصویربرداری.
- اسکن گالیم
- اسکن موگا
- اسکنهای ریوی
- اسکن سستامیبی تکنیتیوم-۹۹ام
- سینتیگرافی تالیم-۲۰۱
- اسکن تیروئید
روشهای تلفیقی یا ترکیبی
ویرایشاین روش ترکیب دو تکنولوژی تصویربرداری مولکولی است که به دلیل احتیاج به تصویربرداری همزمان از چندین هدف مولکولی به وجود آمدهاست. یک کاربرد این تکنولوژی ترکیبی استفاده از تصویربرداری تمام بدن PET/SPECT برای هدایت یک نمونه بردار نوری با اندوسکوپ یا کاتتر و فراهم کردن یک نگاشت با رزولوشن بالا از سیگنالهای فلورسنت در مکانهای مشکوکی که در اسکنهای PET و SPECT دیده میشوند، است.
تلفیق دو روش PET و CT که تحت عنوان PET/CT شناخته شدهاست، روش جدیدی ست که در آن اطلاعات مربوط به آناتومی (حاصل از CT) با اطلاعات متابولیکی که مربوط به عملکرد و اجزا میباشند (آنچه که PET در اختیارمان میگذارد) تلفیق شده و روشی مطلوب بخصوص در مطالعه تومورها میباشد. نکته حائز اهمیت، عدم ضرورت استفاده از دوز بالای CT در این روش است. این روش ۸۵٪ در مطالعه تومورها (تشخیص سلولهای بدخیم از خوشخیم، مشاهده دقیق روند پیشروی سلولهای سرطانی و بررسی پاسخ به درمان و رادیوتراپی)، ۱۰٪ در نورولوژی ،۵٪ در مطالعات قلب، استفاده میشود.
تصویربرداری چند مدالیته به عنوان تصویربرداری از یک شئ با دو یا چند مدالیته و رجیسترکردن تصاویر در زمان و مکان تعریف میشود. اولین دستگاه چند مدالیته SPECT/CT بود که در سال ۱۹۹۰ توسط Bruce Hasegawa پیشنهاد شد. در اواخر دهه ۱۹۹۰ اولین اسکنرهای PET/CT ساخته شدند ولی با این وجود هنوز شکهایی دربارهٔ اهمیت و نقش این دستگاهها وجود داشت. اما امروزه تقریباً غیرممکن است که یک اسکنر PET خریده شود ولی همراه با اسکنر CT نباشد. موفقیت PET/CT باعث شد تا سؤالهایی دربارهٔ آینده این دستگاهها به وجود آید: آیا ترکیبهای مدالیتههای تصویربرداری دیگر نقش مهمی در تحقیقات پزشکی و شناسایی بیماریها میتوانند داشته باشند؟ اگر این چنین است آیا ترکیبهای موفق، ترکیب تکنیکهای تصویربرداری آناتومیکی و عملکردی است یا ترکیب دو مدالیته عملکردی یا آناتومیکی نیز مفید است؟ آیا یک سری قواعد برای پیشرفت این ذستگاههای چند مدالیتهای وجود دارد؟
پیش از ظهور اسکنرهای چند مدالیته PET/CT و SPECT/CT این کار توسط رجیستر کردن نرمافزاری دادهها انجام میشد و برای بافتهایی با هندسه مشخص و حرکت محدود مثل مغز بسیار خوب عمل میکرد ولی در بسیاری از اعضای دیگر رجیستر کردن تصاویر به دلیل تغییر در مکان بیمار در طی دو تصویربرداری جدا، تغییرات زمانی بین دو اسکن که ممکن بود چند روز یا هفته طول بکشد و اطلاعات محدود به دست آمده از تصاویر (به خصوص تصاویر PET وSPECT) بسیار دشوار بود. با این وجود این روشها برای نشان دادن ارزش تصویربرداری چند مدالیتهای مهم بودند و هنوز برای رجیستر کردن مدالیتههایی که برای آنها دستگاههای چند مدالیتهای وجود ندارد استفاده میشوند. در دستگاههای چند مدالیته بیمار از روی تخت تکان نمیخورد و یک مختصات مشخص و ثابت برای انتقال بین تصویرهای حاصل از دو سیستم وجود دارد.[۸]
سیستمهای ترکیبی X-Ray/MRI
ویرایشاین سیستمها ترکیب دو تکنیک تصویربرداری ساختاری برای کاربردهای مداخله گرایانه هستند. تصویربرداری اشعه X رزولوشن فضایی و مکانی بالایی دارد ولی فقط تصاویر دو بعدی ایجاد میکند در حالی که MRI اگرچه کندتر است ولی تصاویر ۳ بعدی فراهم میکند که برای مکانیابی دقیق کمک میکند. در یک تحقیق، یک سیستم تصویربرداری اشعه X درون حفره MRI قرار گرفته و برای جایگذاری شانت رگی در کبد، تصویربرداری مفصلی، کاشتن سید (seed) پروستات، تصویربرداری از مثانه و ناهنجاریهای شریانی استفاده شدهاست.
ترکیب MRI و تصویربرداری نوری
ویرایشدر تصویربرداری نوری از بافتها اطلاعات ساختاری کمی به دست میآید بنابراین دلایل خوبی برای ترکیب تصویربرداری نوری با تصویربرداری ساختاری و سه بعدی MR وجود دارند. کاربردهای آن شامل تصویربرداری از حیوانات کوچک، تصویربرداری از سینه و مغز است. با داشتن دادههای تصویربرداری نوری، تصاویر MR برای مشخص کردن مرز بافتهایی با ویژگیهای نوری متفاوت استفاده میشود و در نتیجه دقت بازسازی ۳ بعدی تصاویر نوری را بالا میبرد.
PET/CT
ویرایشپیشنهاد ترکیب PET و CT در سال ۱۹۹۱ مطرح شد ولی نمونه اصلی اسکنرهای PET/CT در سال ۱۹۹۸ کامل شد. اولین طراحی آن که در مراکز پزشکی استفاده شد در سال ۲۰۰۱ بود. از سال ۲۰۰۱ تاکنون تمام فروشندههای دستگاههای پزشکی حداقل یک طراحی PET/CT را تولید کردهاند در نتیجه از سال ۲۰۰۶ فروش PET/CT جایگزین PET شدهاست.[۹]
در یک دستگاه بیمار ابتدا از میان اسکنر CT رد میشود و سپس وارد اسکنر PET میشود. دو روش مختلف برای استفاده از PET/CT وجود دارد:
- دادههای CT به PET اضافه شدهاست. در این مورد کافی است که کیفیت تصاویر CT در حدی باشد که ساختارهای مورفولوژی مشخص شوند. در نتیجه تصویربرداری CT با یک دز پایین بدون نیاز به مادهٔ حاجب انجام میشود. اطلاعات تصاویر CT برای تصحیح تضعیف تصاویر PET استفاده میشود. این کاربرد در مقایسه با تصویربرداری سنتی PET سریعتر، کم هزینه تر و دقت تشخیص بالاتری دارد.
- جدا از PET، تصویربرداری CT ممکن است برای به دست آوردن اطلاعات تشخیصی و دقت مناسب انجام شود. این به معنای استفاده از دز کامل برای تصویربرداری CT است. استفاده از ماده حاجب معمولاً ضروری است و از یک پروتکل تنفسی استفاده میشود.[۱۰]
- کاربردها
استفاده از PET/CT به عنوان یک وسیله تشخیصی و staging در تومورشناسی بسیار گستردهاست. در تشخیص سرطانهای شش، گردن، سینه، پروستات، روده و… کاربرد دارد.
SPECT/CT
ویرایشSPECT/CT، اطلاعات کاربردی را توسط SPECT و اطلاعات آناتومیکی را از CT به دست میآورد. دادههای CT همچنین برای تصحیح تضعیف دادههای SPECT استفاده میشوند. SPECT/CT از یک اسکنر CT و دوربین گامای جدا از هم و یک تخت مشترک تشکیل شدهاست. ترکیب دادههای CT و SPECT مانند PET/CT انجام میشود.
PET/MRI
ویرایشسیستمهای پت-ام آر آی به تازگی در بیمارستانهای اروپا مورد استفاده قرار گرفتهاند و سازمان اف دی ای آمریکا مجوز این سیستمها را برای استفاده در محیط بالینی به مراکز آمریکایی دادهاست.
روشهای دیگر
ویرایشتصویرگری با امواج THz
ویرایشاین نوع تصویرگری دو گونه اساسی دارد. یک نوع آن استوار است بر میزان عبور از شی، یا به اصطلاح Transmission Based و نوع دیگر آن بر پایه انعکاس استوار است، یا به اصطلاح Reflection Based. تصویرگری با امواج THz بهطور معمول در رطوبت سنجی قرنیه، تشخیص میزان سوختگی پوست، تشخیص محدوده سرطان پوست و طیفسنجی لایه نشانی داروها استفاده میشوند. به دلیل ماهیت غیرتهاجمی و ویژگیهای منحصربهفردی که تکنولوژی تراهرتز دارد، این نوع سیستم تصویرگری به سرعت کاربرد خود را در دهه گذشته افزایش دادهاست. کاربرد تصویرگری با امواج تراهرتز در سرطان پوست، سرطان سینه، حفرههای دندان، در دهه گذشته بسیار پرکاربرد گشتهاست.[۱۱]
در نوع تصویربرداری از امواج الکترومغناطیسی در محدوده فرکانسی 0.1 - 4 THz استفاده میشود. این محدوده از میانه مادون قرمز تا امواج مایکروویو را تشکیل میدهد. محدوده مادون قرمز بیشتر دربارهٔ ساختار مولکولی اشیاء اطلاعات میدهد در حالی که محدوده مایکروویو دربارهٔ ساختار کریستالی اشیاء اطلاعات میدهد. رزولوشن این شیوه از تصویربرداری در حد میلیمتر میباشد.
به دلیل ماهیت غیرتهاجمی و ویژگیهای منحصربهفردی که تکنولوژی تراهرتز دارد، این نوع سیستم تصویرگری به سرعت کاربرد خود را در دهه گذشته افزایش دادهاست. کاربرد تصویرگری با امواج تراهرتز در تشخیص سرطان پوست، سرطان سینه، حفرههای دندان، در دهه گذشته بسیار پرکاربرد گشتهاست. همچنین مطالعات نشان دادهاست که تصویرگری تراهرتز، به خاطر شفافیت بالا میتواند در تصویرگری از میزان بهبود آسیبهای پوستی مؤثر باشد. علت این شفافیت، تغییر میزان رطوبت و ساختار پروتئینی سلولها میباشد که در اثر سوختگی ایجاد میشود. در محدوده طیف الکترومغناطیسی تراهرتز (۳۰۰ گیگاهرتز – ۳ تراهرتز) آب علاوه بر خاصیت جذب بسیار بالای خود، بسیار هم خاصیت دیالکتریکی از خود نشان میدهد؛ بنابراین کوچکترین تغییرات در میزان رطوبت بافت منجر به بازتابشهای متعدد میگردد که این امر به تصویرگری بسیار کمک میکند.[۱۲]
نرمافزارهای استفاده شده در تصویربرداری پزشکی
ویرایشسازمانها
ویرایشنخستین انجمن پرتوشناسی در تاریخ در سال ۱۸۹۷ بنام جامعه رونتگن[پانویس ۱] در لندن تشکیل گردید. این انجمن هم از پزشکها و هم از فیزیکدانها در یک سطح عضو میپذیرفت.[۱۳] امروزه این انجمن مؤسسه رادیولوژی بریتانیا[پانویس ۲] نام دارد. لیکن در سطوح جهانی موسسات گسترده و فراوان دیگری نیز در حال فعالیت میباشند. برخی همانند موسسه ملی تصویربرداری زیستپزشکی موسساتی دولتی اند و برخی دیگر همانند اسپای با بخش خصوصی ارتباط مستقیم دارند.
منابع
ویرایش- ↑ Roobottom CA, Mitchell G, Morgan-Hughes G (November 2010). "Radiation-reduction strategies in cardiac computed tomographic angiography". Clinical Radiology. 65 (11): 859–67. doi:10.1016/j.crad.2010.04.021. PMID 20933639.
- ↑ "Medical Radiation Exposure Of The U.S. Population Greatly Increased Since The Early 1980s" (Press release). National Council on Radiation Protection & Measurements. March 5, 2009. Retrieved May 9, 2019.
- ↑ "Medical Imaging Chip Global Unit Volume To Soar Over the Next Five Years". Silicon Semiconductor. 8 September 2016. Retrieved 25 October 2019.
- ↑ Lancet. January 23, 1896
- ↑ Y.Hoshi, "Functional near-infrared optical imaging: Utility and limitations in human brain mapping", Psychophysiology, 40 (2003), 511–520. Blackwell Publishing Inc.
- ↑ Emil W. Ciurczak, James K. Drennen,"Pharmaceutical and Medical Applications of Near- lnfrared Spectroscopy", Marcel Dekker, Inc. 2002. PP.151.
- ↑ رادیولوژی بالینی آرمسترانگ، ویراست: 2004
- ↑ David W. Townsend: Dual-Modality Imaging: Combining Anatomy and Function. J Nucl Med 2008
- ↑ Simon R. Cherry:MULTIMODALITY IMAGING: BEYOND PET/CT AND SPECT/CT. Semin Nucl Med. 2009 September
- ↑ Z. Brady, M.L. Taylor, M. Haynes, M. Whitaker, A. Mullen, L. Clews, M. Partridge, R. J. Hicks and J.V. Trapp:The clinical application of PET/CT: a contemporary review Australasian Physical & Engineering Sciences in Medicine Volume 31 Number 2, 2008
- ↑ Taylor Z.D. , Rahul D. , Bennet D. "THz Medical Imaging: in vivo Hydration Sensing", IEEE Transaction on Terahertz Science and Technology, Vol. 1, No. 1, Sep 2011.
- ↑ Yao C. , Chun S. “Molecular Imaging with Terahertz Waves”, International Journal of Pharmaceutics Vol. 417, Sep 2011.
- ↑ Roberts JE. Meanderings in Medical Physics. A Personal Account of Hospital Physics. Bristol: IOP Publishing, 1999.