آرایش الکترونی
آرایش الکترونی (به انگلیسی: Electron configuration) نحوه چینش الکترونها در اوربیتالها اطراف هسته اتم را نشان میدهد؛ و شیوه پر شدن زیر لایهها به ترتیب زیر است:
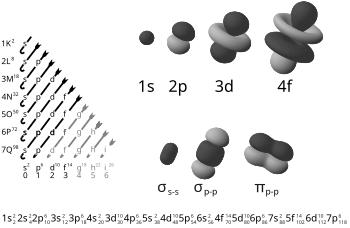
1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p-8s
در s حداکثر ۲ الکترون در p حداکثر ۶ الکترون در d حداکثر ۱۰ و در f حداکثر ۱۴ الکترون قرار میگیرد. بهطور مثال آرایش الکترونی گالیوم که ۳۱ الکترون دارد به صورت زیر نوشته میشود:
۱s۲۲s۲۲p۶۳s۲۳p۶۴s۲۳d۱۰۴p۱
که البته به صورت مرتب شده و به شکل زیر نوشته میشود:
۱s۲۲s۲۲p۶۳s۲۳p۶۳d۱۰۴s۲۴p۱
نکته مهم: در آرایش الکترونی اتم خنثی هرگز زیرلایه d4 یا d9 نداریم دراین حالت باید از زیر لایه s کناری ۱ الکترون کم کرده وبه زیر لایه d میدهیم بر فرض مثال آرایش الکترونی عنصر مس ۲۹ بدینگونه میباشد: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 همانطور که میبینید بر اساس قاعده آفبا باید ان را مرتب کنیم: 1s2 2s2 2p6 3s2 3p6 3d9 4s2 براساس نکته بالا ما باید از زیر لایه s یک الکترون به d بدهیم و تمام که میشود: 1s2 2s2 2p6 3s2 3p6 3d10 4s1
اصل آفبا
ویرایشاصل آفبا (به آلمانی: Aufbau)، به معنی ساختن یکی از اصول آرایش الکترونی است که میگوید: ترتیب عناصر پرشدن لایهٔ الکترونی به صورت ۲(۸(۸(۲(است و اگر الکترون باقی ماند آن را به لایهٔ سوم یعنی:۲(۸+۸(۸(۲(پر میکنیم. (لایهٔ سوم را تا سقف ۱۸ الکترون میتوان پر کرد)
- در پرشدن اوربیتالها ابتدا اوربیتالهای با انرژی کمتر (n+l کوچکتر) پر میشوند و سپس اوربیتالهای با انرژی بیشتر (n+l بزرگتر).
این اصل برای ۱۸ عنصر اول به خوبی صدق میکند. اما اصل مادلونگ که در سال ۱۹۳۶ و توسط آروین مادلونگ ارائه شد به خوبی تا ۱۰۰ عنصر اول صدق میکند[۱]
- Orbitals are filled in the order of increasing n+l;
- Where two orbitals have the same value of n+l, they are filled in order of increasing n.
از طریق این اصل ترتیب پرشدن اوربیتالها بدین گونه است:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
استثناها
ویرایش| دوره ۵ | دوره ۶ | دوره ۷ | ||||||||
| عنصر | Z | آرایش الکترونی | عنصر | Z | آرایش الکترونی | عنصر | Z | آرایش الکترونی | ||
| ایتریوم | ۳۹ | [Kr] 5s2 4d1 | لانتان | ۵۷ | [Xe] 6s2 5d1 | آکتینیوم | ۸۹ | [Rn] 7s2 6d1 | ||
| سریوم | ۵۸ | [Xe] 6s2 4f1 5d1 | توریوم | ۹۰ | [Rn] 7s2 6d2 | |||||
| پرازئودیمیوم | ۵۹ | [Xe] 6s2 4f3 | پروتاکتینیوم | ۹۱ | [Rn] 7s2 5f2 6d1 | |||||
| نئودیمیوم | ۶۰ | [Xe] 6s2 4f4 | اورانیوم | ۹۲ | [Rn] 7s2 5f3 6d1 | |||||
| پرومتیوم | ۶۱ | [Xe] 6s2 4f5 | نپتونیوم | ۹۳ | [Rn] 7s2 5f4 6d1 | |||||
| ساماریوم | ۶۲ | [Xe] 6s2 4f6 | پلوتونیوم | ۹۴ | [Rn] 7s2 5f6 | |||||
| یوروپیم | ۶۳ | [Xe] 6s2 4f7 | امریسیم | ۹۵ | [Rn] 7s2 5f7 | |||||
| گادولینیوم | ۶۴ | [Xe] 6s2 4f7 5d1 | کوریوم | ۹۶ | [Rn] 7s2 5f7 6d1 | |||||
| تربیوم | ۶۵ | [Xe] 6s2 4f9 | برکلیوم | ۹۷ | [Rn] 7s2 5f9 | |||||
| زیرکونیوم | ۴۰ | [Kr] 5s2 4d2 | هافنیوم | ۷۲ | [Xe] 6s2 4f14 5d2 | |||||
| نیوبیوم | ۴۱ | [Kr] 5s1 4d4 | تانتال | ۷۳ | [Xe] 6s2 4f14 5d3 | |||||
| مولیبدن | ۴۲ | [Kr] 5s1 4d5 | تنگستن | ۷۴ | [Xe] 6s2 4f14 5d4 | |||||
| تکنسیوم | ۴۳ | [Kr] 5s2 4d5 | رنیوم | ۷۵ | [Xe] 6s2 4f14 5d5 | |||||
| روتنیوم | ۴۴ | [Kr] 5s1 4d7 | اسمیوم | ۷۶ | [Xe] 6s2 4f14 5d6 | |||||
| رودیوم | ۴۵ | [Kr] 5s1 4d8 | ایریدیوم | ۷۷ | [Xe] 6s2 4f14 5d7 | |||||
| پالادیوم | ۴۶ | [Kr] 4d10 | پلاتین | ۷۸ | [Xe] 6s1 4f14 5d9 | |||||
| نقره | ۴۷ | [Kr] 5s1 4d10 | طلا | ۷۹ | [Xe] 6s1 4f14 5d10 | |||||
| کادمیوم | ۴۸ | [Kr] 5s2 4d10 | جیوه | ۸۰ | [Xe] 6s2 4f14 5d10 | |||||
| ایندیم | ۴۹ | [Kr] 5s2 4d10 5p1 | تالیوم | ۸۱ | [Xe] 6s2 4f14 5d10 6p1 | |||||
جستارهای وابسته
ویرایشمنابع
ویرایش- Jolly, William L. (1991). Modern Inorganic Chemistry (به انگلیسی) (2nd ed.). New York: McGraw-Hill. p. ۱–۲۳.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - Wikipedia contributors, "Electron configuration," Wikipedia, The Free Encyclopedia, http://en.wiki.x.io/w/index.php?title=Electron_configuration&oldid=269957354 (accessed February 14, 2009).
- ↑ Madelung's rule is sometimes known as Klechkowski's rule, especially in French-speaking countries.